Samenvatting
Directe orale anticoagulantia (DOAC’s) – drie factor Xa-remmers en een factor IIa-remmer – vormen een interessante ontwikkeling met nieuwe werkingsmechanismen bij het ingrijpen in het proces van bloedstolling. Er is veel discussie over de voor- en nadelen van DOAC’s ten opzichte van de klassieke vitamine K-antagonisten. De werkzaamheid van de nieuwe Xa-remmer edoxaban (Lixiana®) is aangetoond bij patiënten met atriumfibrilleren en bij veneuze trombose in twee grote internationale gerandomiseerde klinische onderzoeken en in een observationele cohortstudie. De werking en de bijwerkingen zijn vergelijkbaar met de al bestaande Xa-remmers rivaroxaban en apixaban en de IIa-remmer dabigatran. Er is echter nog geen ervaring in de praktijk met edoxaban. Conclusie: edoxaban biedt geen voordeel boven de al aanwezige middelen.
L.M.L. Stolk, R.W.G. Bruggeman, onder medeverantwoordelijkheid van de redactie
Pharma Selecta 2016 (februari) nr 2 Pharm Sel 2016;32:14-17.
Abstract
Direct oral anticoagulants (DOACs), three factor Xa inhibitors and a factor IIa inhibitor, represent a promising new approach, with a new mechanism for anticoagulation. However, there is considerable debate about the relative advantages and disadvantages of DOACs compared with classical vitamin K antagonists. The new factor Xa inhibitor edoxaban (Lixiana®) has proven effective in patients with atrial fibrillation or venous thrombosis in two large international randomized clinical trials and an observational cohort study. The action and side effects of edoxaban are similar to those of the existing factor Xa inhibitors rivaroxaban and apixaban and to those of the factor IIa inhibitor dabigatran; however, as yet there is no clinical experience with edoxaban. In conclusion, edoxaban does not provide additional benefit relative to existing agents.
Inleiding
De directe orale anticoagulantia (DOAC’s), ook wel de nieuwe orale anticoagulantia (NOAC’s) genoemd, vormen een nieuwe klasse antitrombotica, naast de al lang bestaande vitamine K-antagonisten fenprocoumon en acenocoumarol. Internationaal wordt ook wel de term novel of non-vitamin-K antagonists oral anticoagulants (NOAC’s) gebruikt en in de Verenigde Staten de benaming target-specific oral anticoagulants (TSOAC’s) .[1,2]
De DOAC’s bestaan uit de factor IIa-remmer (directe trombineremmer) dabigatran (Pradaxa®) en de factor Xa-remmers rivaroxaban (Xarelto®) en apixaban (Eliquis®). Deze middelen zijn in de afgelopen jaren geregistreerd, met als indicaties profylaxe van cerebrovasculair accident (CVA) en systemische embolie bij patiënten met atriumfibrilleren, alsmede de behandeling van diepveneuze trombose en pulmonale embolie en profylaxe van diepveneuze trombose na heup- en knieoperaties.[3] In vergelijking met de DOAC’s hebben de vitamine K-antagonisten als nadeel dat de patiënt, op geleide van de INR, op de juiste dosis moet worden ingesteld en periodiek moeten worden gemonitord. Bovendien moet er rekening worden gehouden met interacties. De DOAC’s behoeven niet te worden gemonitord. Nadelen van DOAC’s zijn een kortere halfwaardetijd, het niet kunnen volgen van de therapietrouw door middel van monitoring, de nog relatief beperkte ervaring en de afwezigheid van een antidotum voor de factor Xa-remmers. Een antidotum, specifiek voor de IIa-remmer dabigatran, is onlangs via een versnelde procedure door de EMA, mogelijk na onvoldoende klinisch onderzoek, aanbevolen voor registratie: idarucizumab (Praxbind®).[4] Overigens wordt in de NHG-standaarden Diepe veneuze trombose en longembolie en Atriumfibrilleren het gebruik van DOAC’s momenteel niet aanbevolen.[5,6]
In januari 2015 (FDA) en april 2015 (EMA) werd een nieuwe Xa-remmer goedgekeurd: edoxaban met de merknaam Lixiana®. De indicaties zijn: preventie van CVA en systemische embolie bij atriumfibrilleren met een risicofactor en behandeling en preventie van diepveneuze trombose en pulmonale embolie.7
In dit overzichtsartikel wordt ingegaan op de farmacologie van edoxaban en de plaats in de farmacotherapie.
Farmacologie
Dynamiek
Edoxaban is een directe reversibele remmer van factor Xa. Factor Xa katalyseert de omzetting van protrombine naar trombine. Remming van factor Xa in de stollingscascade vermindert de vorming van trombine, verlengt de stollingstijd en vermindert het risico op thrombusvorming.[1,7]
Kinetiek
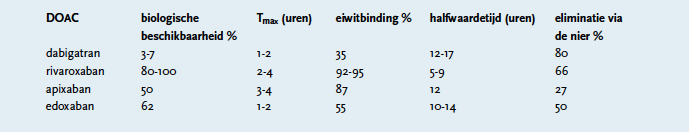
Piekplasmaconcentraties van edoxaban worden bereikt binnen één à twee uur na inname per os. De biologische beschikbaarheid is ongeveer 62%. Voedsel heeft geen invloed op de totaal opgenomen hoeveelheid. Het distributievolume is 107 + 19 L. Edoxaban is substraat voor P-glycoproteïne. Metabolisering: door hydrolyse, conjugatie of oxidatie door CYP3A4/5 (<10%) tot drie actieve en vier inactieve metabolieten. Eliminatie: 35% met de urine (onveranderd). De resterende klaring verloopt via metabolisme en gal- en/of intestinale uitscheiding. De eliminatiehalfwaardetijd is 10-14 uur. Er is een lineair verband tussen de concentratie van edoxaban in plasma en de anti-FXa-activiteit. Er is geen verschil in kinetiek tussen ouderen en jongeren en mannen en vrouwen. Bij gewicht <60 kg werd verhoging van AUC gezien. De klaring neemt af bij verminderde nierfunctie, zodat de dosis moet worden aangepast. Bij lichte tot matige leverfunctiestoornis werd geen verandering van de kinetiek gezien.[1,7] Een overzicht van de kinetische parameters van alle DOAC’s is weergegeven in Tabel 1.[1]
Klinische studies
Edoxaban is geëvalueerd in twee grote gerandomiseerde dubbelblinde placebo-gecontroleerde fase 3-onderzoeken: de ENGAGE AF-TIMI 48-studie met patiënten met non-valvulair atriumfibrilleren (NVAF) en de Hokusai-VTE-studie bij patiënten met diepveneuze trombose (DVT).[8,9]
De beide onderzoeken waren non-inferioriteitstudies. Van belang bij non-inferioriteitsstudies zijn een onderbouwde keuze van de vooraf vastgestelde inferioriteitsmarge, een optimale controlebehandeling en ‘per protocol’ analyse.[10]
ENGAGE AF-TIMI 48 [8]
In totaal werden 21.105 patiënten met NVAF met een matig tot verhoogd risico op een beroerte (CHADS2-score >2) geïncludeerd. Er waren drie groepen: een hoge-dosis-groep (60 mg edoxaban eenmaal daags) en een lage-dosis-groep (30 mg edoxaban eenmaal daags) werden vergeleken met een groep met warfarine (dosering aangepast tot INR 2-3). Het primaire eindpunt was een beroerte of systemische embolie en het betrof een non-inferioriteitsstudie met modified intention to treat analyse. De inferioriteitsmarge was vooraf vastgesteld op 1,38. De mediane follow-up was 1022 dagen. Het resultaat was een significante vermindering van het aantal beroertes en systemische embolieën in de hoge-dosis-edoxabangroep (1,18% per jaar) vergeleken met de warfarinegroep (1,5% per jaar): hazard ratio (HR) 0,79; CI 97,5% 0,63-0,99; p<0,001 voor non-inferioriteit en p=0,02 voor superioriteit. Voor de lage-dosis-groep was dit 1,61% per jaar. Er is daar geen significant verschil voor superioriteit gevonden, maar wel voor non-inferioriteit: HR 1,07; CI 97,5% 0,87-1,31; p<0,005 (non-inferioriteit) en p=0,44 (superioriteit). Het aantal grote bloedingen was voor warfarine 3,43% per jaar en voor de hoge-dosis-edoxabangroep significant lager, namelijk 2,75%: HR 0,80; CI 95% 0,71-0,91; p<0,001. Dit gold ook voor de lage-dosis-edoxabangroep met 1,61%: HR 0,47; CI 95% 0,41-0,55; p<0,001.
Hokusai-VTE [9]
Er werden 4921 patiënten met diepveneuze trombose en 3319 patiënten met pulmonaire embolie geïncludeerd. Patiënten kregen drie tot twaalf maanden eenmaal daags 60 mg edoxaban (of 30 mg wanneer dosisaanpassing nodig was in verband met de creatinineklaring of gewicht <60 kg) of warfarine. Alle patiënten kregen eerst open label vijf dagen enoxaparine of ongefractioneerde heparine en werden vervolgens gerandomiseerd voor edoxaban of warfarine. Het primaire eindpunt was veneuze trombo-embolie (VTE). Het was een non-inferioriteitsstudie met als vooraf bepaalde inferioriteitsmarge 1,5. Het aantal VTE’s in de edoxabangroep (3,2%) was niet inferieur aan die in de warfarinegroep (3,5%) volgens de modified intention to treat analyse: HR 0,89; CI 95% 0,7-1,13; p<0,001. Voor inferioriteitsonderzoek is echter per protocol analyse de juiste methode.[10] Het aantal grote bloedingen was met edoxaban (8,5%) significant minder dan met warfarine (10,3%): HR 0,81; CI 95% 0,71-0,94; p<0,004. Vergelijking met de resultaten van de gerandomiseerde gecontroleerde onderzoeken met andere, al langer in de handel zijnde DOAC’s is moeilijk, omdat de eigenschappen bij inclusie van de onderzoekpopulaties nogal verschilden, zoals leeftijd, risicoklasse en de mate van juiste instelling op warfarine (de gouden standaard).[11]
Observationeel onderzoek
Een beperking van gerandomiseerde gecontroleerde onderzoeken is vaak dat de geïncludeerde patiënten niet overeenkomen met de patiënten die in de dagelijkse praktijk in aanmerking zouden komen voor therapie. In een recente studie werd gevonden dat slechts ongeveer tweederde (51-68%) van de patiënten met atriumfibrilleren die in het Verenigd Koninkrijk in aanmerking zou komen voor anticoagulatie en die door de clinical practice research datalink (CPRD) waren geïndentificeerd, voldeed aan de inclusiecriteria voor gerandomiseerde gecontroleerde onderzoeken voor DOAC’s.[12] Observationele cohortonderzoeken hebben dit nadeel niet en kunnen een betere afspiegeling zijn van de patiënten uit de praktijk.
Er is één observationele cohortsstudie over edoxaban gepubliceerd.[13] Het cohort betreft 96.308 Deense patiënten met NVAF van het Danish National Patient Registry die tussen 1997 en 2008 gediagnosticeerd waren voor AF. Er waren van deze patiënten gedetailleerde gegevens beschikbaar, zoals farmacotherapie en risico op beroerte en bloedingen. De patiënten zijn gemiddeld 3,83 jaar gevolgd. Het aantal gebeurtenissen (beroerte of systemische embolie) per 100 patiëntjaren was: 1,0 (geen behandeling), 0,53 (warfarine), 0,57 (edoxaban 30 mg) en 0,42 (edoxaban 60 mg). Vergeleken werd het netto klinische voordeel: het aantal gebeurtenissen dat wordt voorkomen per 100 patiëntjaren. Het netto klinische voordeel was 0,26 voor warfarine, 0,71 voor edoxaban 30 mg en 0,71 voor edoxaban 60 mg; het was het grootst bij de patiënten uit de hoogste risicoklasse.
Bijwerkingen
In de twee belangrijkste fase 3-studies, de ENGAGE-AF-TIMI 48-studie en de Hokusai-VTE-studie, zijn de volgende vaak voorkomende (>1/100 en <1/10) bijwerkingen gevonden: bloedingen, anemie, verhoging gamma-GT, jeuk en uitslag.[7]
Interacties
Omdat edoxaban substraat is van P-gp, zijn interacties met P-gp-remmers mogelijk. In combinatie met ciclosporine, dronedarone, erythromycine en ketoconazol moet de dosering worden aangepast. Aanpassing van de dosering met kinidine, verapamil en amiodaron is niet nodig. In combinatie met P-gp-stimulerende geneesmiddelen rifampicine, fenytoïne, carbamazepine, fenobarbital en sint-janskruid is voorzichtigheid geboden.[7]
 Contra-indicaties
Contra-indicaties
Contra-indicaties zijn aangegeven voor overgevoeligheid voor edoxaban of een van de hulpstoffen, klinische significante actieve bloedingen, leverziekte geassocieerd met stollingsstoornis en klinisch relevante bloedingen, lesies of condities die risico vormen voor bloeding, ongecontroleerde ernstige hypertensie en gelijktijdige toediening van andere anticoagulantia.[7]
Bijzondere voorzorgen
– Bloedingen. Edoxaban verhoogt het risico op bloedingen en kan ernstige, mogelijke fatale bloedingen veroorzaken. Voorzichtigheid is geboden bij patiënten met verhoogde kans op bloeding.[7]
– Bij de combinatie van edoxaban en acetylsalicylzuur aan ouderen is voorzichtigheid geboden in verband met de kans op bloedingen.
– Nierfunctie. Bij het starten van de therapie moet de creatinineklaring worden onderzocht. Voorzichtigheid wordt aanbevolen bij patiënten met verhoogde creatinineklaring.
– Bij patiënten met ernstige nierfunctiestoornis of dialyse wordt edoxaban niet aanbevolen.
– Leverfunctie. Edoxaban wordt niet aanbevolen bij patiënten met ernstige leverfunctiestoornis.
Zwangerschap en lactatie
Veiligheid en effectiviteit van edoxaban zijn niet onderzocht bij zwangeren. Toxiciteit ten aanzien van de reproductie werd gezien in dierproeven. Om die reden, en wegens het intrinsieke risico op bloedingen en de gebleken potentie om de placenta te passeren, is edoxaban gecontraïndiceerd bij zwangerschap.
Veiligheid en effectiviteit van edoxaban zijn niet onderzocht bij vrouwen die borstvoeding geven. Gegevens uit dierproeven geven aan dat uitscheiding via de moedermelk mogelijk is. Edoxaban is daarom gecontraïndiceerd tijdens de lactatieperiode.[7]
Handelspreparaat, dosering en prijs
Edoxaban wordt onder de naam Lixiana® in de handel gebracht door Daiichi Sankyo als film-omhulde tabletten van 15, 30 en 60 mg (als tosilaat). De dosering is eenmaal daags 60 mg. Een dosis van 30 mg eenmaal daags wordt aanbevolen bij matige tot ernstige verminderde nierfuctie (CrCL 15-50 ml/min) en laag lichaamsgewicht (<60 kg) en verder bij gelijktijdig gebruik van de P-gp-remmers ciclosporine, dronedarone, erythromycine en ketoconazol.
De tablet kan worden ingenomen met of zonder voedsel.
Lixiana® wordt vergoed vanuit de basisverzekerering. De prijs is 78,86 euro voor 30 tabletten van 60 mg. Dit bedrag is vergelijkbaar met de ander DOAC’s.[14]
Conclusies
DOAC’s vormen een interessante ontwikkeling met nieuwe werkingsmechanismen voor het ingrijpen in het proces van de stolling. Er zijn praktische voordelen voor de DOAC’s, maar ook nadelen ten opzichte van de vitamine K-antagonisten. De werkzaamheid van de nieuwe Xa-remmer edoxaban is aangetoond zowel bij patiënten met atriumfibrilleren als met veneuze trombose in twee grote internationale gerandomiseerde klinische onderzoeken en in één observationele cohortsstudie. De werking en de bijwerkingen zijn vergelijkbaar met de al bestaande Xa-remmers en de IIa-remmer. Er is echter nog geen ervaring in de praktijk met edoxaban. Conclusie: edoxaban biedt geen voordeel ten opzichte van de middelen die al voorhanden zijn.
Literatuur
1 Minor C, Tellor K, Armbruster A. Edoxaban, a novel oral factor Xa inhibitor. Ann Pharmacother 201;49:843-850.
2 Anoniem. NOAC of DOAC: de strijd is nog niet beslist. Pharm Weekbl 2015;150(52):17.
3 www.fk.cvz.nl. Farmacotherapeutisch Kompas.
4 Anoniem. Idarucizumab: een eerste antidotum tegen bloedingen door directe orale antistollingsmiddelen. Geneesmiddelenbuletin 2015;10:121-122.
5 NHG-werkgroep Diepe veneuze trombose en longembolie. NHG-standaard Diepe veneuze trombose en longembolie (eerste herziening). Huisarts Wet 2015;58:26-35.
6 NHG-werkgroep Atriumfibrilleren. NHG-standaard Atriumfibrilleren (tweede partiele herziening). Huisarts Wet 2013;56:1-25.
7 Anoniem. Lixinia. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002629/WC500189045.pdf. Geraadpleegd 27-12-2015.
8 Gugliano R, Ruff C, Braunwald E et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369:2093-2104.
9 Büller H, Décousus H, Grosso M et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. Hokusai-VTE investigators. N Eng J Med 2013;369:1406-1415.
10 Dekkers O. Het non-inferioriteitsonderzoek. Geneesmiddelenbulletin 2015;49:27-34.
11 Dobesh P, Fanikos J. Direct oral anticoagulants for the prevention of stroke in patients with nonvalvular atrial fibrillation: understanding differences and similarities. Drugs 2015;75:1627-1644.
12 Lee S, Monz B, Clemens A, Brueckmann M, Lip G. Representativeness of the dabigatran, apixaban and rivaroxaban clinical trial populations to real-world atrial fibrillation patients in the United Kingdom: a cross-sectional analysis using the General Practice Research Database. Br Med J Open 2012;2:e001768.
13 Blann A, Banerjee A, Lane D et al. Net clinical benefit of edoxaban versus no treatment in a ‘real world’ atrial fibrillation population: A modelling analysis based on a nationwide cohort study. Int J Cardiol 2015;201:693-698.
14 Zorginstituut Nederland. http://www.medicijnkosten.nl/default.asp?zoekterm=edoxaban. Geraadpleegd 30-01-2016.