Samenvatting
Brivaracetam (Briviact®) is onlangs geïntroduceerd en geregistreerd als adjuvante therapie voor de behandeling van partieel beginnende epileptische aanvallen met of zonder secundaire generalisatie bij volwassen en adolescenten vanaf zestien jaar. Brivaracetam heeft een hoge en selectieve affiniteit voor het synaptisch vesikeleiwit 2A (SV2A). Men neemt aan dat de binding met SV2A het primaire mechanisme is voor de anticonvulsieve werking van brivaracetam. Levetiracetam heeft een vergelijkbaar werkingsmechanisme. De effectiviteit als adjuvante therapie is in placebo-gecontroleerde studies aangetoond. Een indirecte vergelijking door middel van meta-analyses gaf aan dat er geen statistisch significant verschil is in effectiviteit tussen brivaracetam en levetiracetam. Zowel tabletten als drank vallen binnen het geneesmiddelvergoedingssysteem. Vooralsnog is brivaracetam een middel van tweede keus als add-on bij de behandeling van partiële epilepsie. De toekomst zal uitwijzen of het een eerstekeusmiddel wordt.
J.J.M. Coremans en L.I. van de Ven, onder medeverantwoordelijkheid van de redactie
Pharma Selecta 2016 (december) Pharm Sel 2016;32:92-94.
Abstract
Brivaracetam (Briviact®) has recently been approved as add-on treatment for adults with epilepsy (aged 16 years and older) with partial seizures with or without secondary generalized seizures. It has a high and selective affinity for the synaptic vesicle protein 2A, and it is the binding of brivaracetam to SV2A that is thought to be the primary mechanism underlying its anti-convulsive action. Levetiracetam has a similar mechanism of action. The effectiveness of brivaracetam as add-on therapy has been demonstrated in placebo-controlled studies. Indirect comparison with levetiracetam in a meta-analysis showed no significant difference in effectiveness between the two drugs. Both the tablet and oral solution forms are covered by the medicine reimbursement system. For the moment, brivaracetam is the drug of second choice as add-on therapy for partial epilepsy. Future studies will show whether it will become the drug of first choice.
Inleiding
Epilepsie is een aandoening van de hersenen, gekenmerkt door spontane, onvoorspelbare aanvallen van mogelijk tijdelijke bewustzijnsverandering en/of verlies van spiercontrole. Laesies in de hersenen vergroten de kans op symptomatische epilepsie. Deze laesies kunnen onder andere veroorzaakt worden door beroerte, zuurstoftekort in de hersenen en infecties. Hoe ouder men wordt, hoe meer kans er is om de specifieke oorzaak te vinden. Bij een epileptische aanval kunnen er verschillende symptomen optreden:
– motorische: spiercontracties;
– sensorische: veranderingen in horen, zien en voelen;
– autonome: zweten, misselijkheid, hartkloppingen;
– psychomotorische: tijdelijke gestoorde geheugen en/of aangetaste spraakfunctie;
– psychische: angst, woede, vreugde.
Er wordt een onderscheid gemaakt tussen partiële en gegeneraliseerde aanvallen. Bij een partiële aanval – ook wel lokalisatie gebonden of focale aanval genoemd – is de oorsprong plaatselijk in een deel van de hemisfeer gelegen. Een focale aanval leidt niet tot disfunctie van één hersengebied maar kan uitbreiden en zelfs leiden tot een secundair gegeneraliseerde tonisch-klonische aanval.
Het aantal nieuwe gevallen van epilepsie per jaar in Nederland wordt geschat op 30 per 100.000 mensen van veertien jaar of ouder. Op een willekeurig moment in het jaar worden meer dan 80.000 mensen behandeld voor epilepsie; hiervan heeft naar schatting 60% partiële epilepsie. Wie na zijn dertigste epilepsie krijgt, heeft partiële epilepsie.[1]
Preventie van de aanvallen vormt het hoofddoel van de behandeling van epilepsie. De aanvallen belemmeren het maatschappelijk functioneren. Daarnaast is er een – zij het beperkt – risico van een ongeval. Behandeling is doorgaans pas na een tweede aanval binnen twee jaar geïndiceerd, tenzij na de eerste aanval in het elektro-encefalogram (EEG) specifieke afwijkingen worden gezien. De diagnose wordt vooral gesteld op grond van de anamnese, met name van de aanvalsbeschrijvingen en ondersteuning door EEG-bevindingen. Niet alle insulten berusten op epilepsie. Koorts, hypoglykemie of meningitis, maar ook het plotseling staken van anti-epileptica, anxiolytica of alcohol kunnen zogenaamde gelegenheidsinsulten veroorzaken.[2]
De meeste anti-epileptica hebben verschillende aangrijpingspunten.[3] Het aanhoudend repetitief ontladen van neuronen kan worden verminderd door blokkade van Na+-kanalen, blokkade van glutamaatreceptoren of van voltage-afhankelijke Ca2+-kanalen. Middelen die een van deze effecten hebben, zijn werkzaam tegen partiële en gegeneraliseerde tonisch-klonische aanvallen. Voorbeelden hiervan zijn carbamazepine, oxcarbazepine, fenytoïne en lamotrigine. Middelen die de GABA-erge transmissie verhogen, kunnen tegen alle aanvalstypen werkzaam zijn. Voorbeelden van GABA-agonisten zijn diazepam, clonazepam, vigabatrine en tiagabine. Middelen die zowel de Na+-kanalen blokkeren als de GABA-erge transmissie verhogen zijn fenobarbital, gabapentine, topiramaat en valproaat. Het is zeer goed mogelijk dat juist de combinatie van deze mechanismen – in de juiste verhouding – verantwoordelijk is voor het uiteindelijke effect. Sommige patiënten reageren bijvoorbeeld onvoldoende op het ene Na+-kanaal-blokkerende middel en blijken wel te reageren op het andere. Zo kan het voorkomen dat een patiënt onvoldoende reageert op fenytoïne maar wel effect ondervindt van carbamazepine. De behandeling van epilepsie kent een aspect van trial and error.
Van alle typen epileptische aanvallen zijn de partiële het moeilijkst te behandelen. Ongeveer 60% van de patiënten met een nieuw gediagnosticeerde partiële epilepsie wordt aanvalsvrij met monotherapie. Verder bereikt 10 à 20% dit door combinatie met meerdere anti-epileptica. Ongeveer 30% van de patiënten met partiële epilepsie is refractair voor behandeling (EMA-richtlijn epilepsie, 2010). Patiënten met therapieresistente partiële epilepsie worden zelden aanvalsvrij. Nieuwe anti-epileptica worden in het algemeen eerst als adjuvante therapie getest bij patiënten die onvoldoende reageren op de bestaande combinaties.
Brivaracetam, met de merknaam Briviact®, is geregistreerd als adjuvante therapie bij partiële epilepsie, met of zonder secundair gegeneraliseerde aanvallen, bij volwassen en adolescenten vanaf zestien jaar. Het toepassingsgebied is gericht op patiënten met therapieresistentie voor de eerstelijnsmiddelen die om te beginnen als monotherapie worden ingezet.
Farmacologie
Dynamiek
Brivaracetam vertoont een hoge en selectieve affiniteit voor het eiwit synaptic vesicle protein 2A (SV2A), een transmembraan glycoproteïne dat op presynaptisch niveau in neuronen en endocriene cellen wordt aangetroffen. Hoewel de exacte rol van dit eiwit nog moet worden verklaard, is aangetoond dat het de exocytose van neurotransmitters moduleert. Men neemt aan dat de binding aan SV2A het primaire mechanisme is voor de anticonvulsieve werking van brivaracetam.[4]
Kinetiek
Na orale toediening bedraagt de biologische beschikbaarheid bijna 100%. Bij inname zonder voedsel wordt de Cmax na ongeveer één uur bereikt. Bij inname met vetrijk voedsel wordt de Cmax na ongeveer drie uur bereikt en is ongeveer 37% lager; de absorptie blijft hetzelfde. Brivaracetam wordt voor ongeveer 60% gemetaboliseerd door hydrolyse van de amidegroep tot een inactieve carboxylzuurmetaboliet en voor ongeveer 30% door hydroxylering via hoofdzakelijk CYP2C19 op de propylzijketen tot inactieve metabolieten. Deze worden verder gemetaboliseerd tot een inactief gehydroxyleerd zuur. Brivaracetam wordt voor meer dan 95% uitgescheiden met de urine, waarvan minder dan 10% in onveranderde vorm. Minder dan 1% wordt met de feces uitgescheiden. De eliminatiehalfwaardetijd bedraagt ongeveer negen uur.[4]
Therapeutic drug monitoring (TDM) wordt voor brivaracetam (nog) niet geadviseerd. Uit de TDM-monografie van levetiracetam volgt dat dit middel relatief minder toxisch is in hogere concentraties dan vele andere anti-epileptica met aangrijpingspunten direct op het Na/K- en/of GABA-systeem. Een eenduidig effectiviteit-toxiciteit-serumconcentratieprofiel lijkt er niet te zijn. De rol van TDM is derhalve ook geringer dan bij de klassiekere middelen.[5]
Klinisch onderzoek
Er is een meta-analyse gepubliceerd waarin twee fase 2b- en vier fase 3-studies zijn meegenomen, waarin de veiligheid en werkzaamheid van brivaracetam is onderzocht als toevoeging aan een behandeling van partiële epilepsie bij therapieresistente patiënten. In de meta-analyse werden zes gerandomiseerde, dubbel of single blind, placebo-gecontroleerde add-on studies geïncludeerd met in totaal 2399 patiënten. Hiervan kregen 1715 brivaracetam en 684 placebo. De primaire eindpunten in deze studies waren de 50% responder rate (het percentage patiënten waarbij een aanvalsvermindering van 50% wordt bereikt) en het aantal aanvalsvrije patiënten. Het overall RR voor 50% responder rate bij patiënten in de geïncludeerde studies was 1,79 (95% BI 1,51-2,12). Dit wil zeggen dat de kans 1,79 keer zo groot is dat de patiënten die brivaracetam gebruikten de 50% responder rate bereiken in vergelijking met patiënten die placebo kregen. De overall RR voor de 50% responder rate bij patiënten die brivaracetam naast levetiracetam gebruikten, was 0,88 (95% BI 0,46-1,68) in vergelijking met patiënten die daarnaast placebo kregen. Dit betekent dat de kans dat minder patiënten die brivaracetam gebruikten samen met levetiracetam de 50% responder rate bereikten in vergelijking met patiënten die placebo gebruikten samen met levetiracetam. De overall RR om aanvalsvrij te blijven tijdens het gebruik van brivaracetam was 4,74 (95% BI 2,00-11,25). De kans is dus 4,74 keer zo groot is dat de patiënten die brivaracetam gebruiken aanvalsvrij blijven in vergelijking met de placebogebruikers. Brivaracetam als add-on gaf in vergelijking met placebo significant meer vermoeidheid, duizeligheid, slaperigheid en prikkelbaarheid.[6]
Een andere studie is de meta-analyse van een indirecte vergelijking tussen levetiracetam en brivaracetam bij volwassenen met partiële epilepsie. In deze meta-analyse werden dertien gerandomiseerde, dubbel- of single blind, placebo-gecontroleerde studies geïncludeerd met in totaal 3684 patiënten. Van hen kregen 1765 brivaracetam en 1919 levetiracetam. De indirecte vergelijking gaf aan dat er geen statistisch significant verschil is in effectiviteit voor alle doses van brivaracetam en levetiracetam.[7]
Bijwerkingen
De meest voorkomende bijwerkingen waren duizeligheid en slaperigheid. Bij 1-10% trad influenza, infecties van de bovenste luchtwegen, hoest, verminderde eetlust, depressie, angst, slapeloosheid, prikkelbaarheid, convulsies, vertigo, misselijkheid, braken, obstipatie en vermoeidheid op. Minder dan 1% meldde suïcidale gedachten, psychotische stoornis, agressie, agitatie en neutropenie.[4]
Interacties
Er is één, niet door de KNMP beoordeelde, interactie: de AUC daalt met ongeveer 45% wanneer brivaracetam samen gebruikt wordt met rifampicine.[4]
Contra-indicaties
Overgevoeligheid en voorzichtigheid is geboden bij leverfunctiestoornis. Bij lichte, matige en ernstige leverfunctiestoornis (Child-Pugh A, B en C) is de blootstelling verhoogd met respectievelijk 50, 57 en 59%.[4]
Zwangerschap en lactatie
Over gebruik van brivaracetam tijdens de zwangerschap bij de mens is onvoldoende bekend. Gebruik tijdens de zwangerschap wordt ontraden. Het is niet bekend of het overgaat in de moedermelk. In dierproeven is dit wel aangetoond.[4]
Preparaat, dosering en prijzen
Brivaracetam is door de firma UCB Pharma BV op de markt gebracht onder de naam Briviact® in tabletvorm in de sterktes 25, 50, 75, en 100 mg, als drank 10 mg/ml 300 ml en als injectievloeistof 10 mg/ml 5 ml. De dosering voor volwassenen en adolescenten vanaf zestien jaar is aanvankelijk 50 of 100 mg per dag in twee doses, zo nodig verhogen tot maximaal 200 mg per dag. Er is geen ervaring met intraveneuze toediening langer dan vier dagen. Bij leverfunctiestoornis aanvankelijk 50 mg per dag in twee doses; zo nodig te verhogen tot maximaal 150 mg per dag in twee doses. Bij staken dient de dagdosering wekelijks afgebouwd te worden met 50 mg, vervolgens gedurende één week 50 mg per dag, daarna gedurende één week 20 mg per dag, waarna de behandeling kan worden gestaakt.[4]
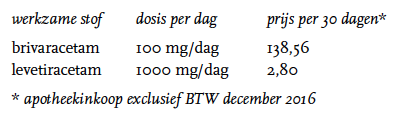
Voorlichting aan de patiënt
Brivaracetam heeft volgens de fabrikant in de therapeutische dosering een licht tot matig negatieve invloed op de rijvaardigheid en de bediening van machines.[4]
Conclusie
Brivaracetam heeft, net als levetiracetam, een hoge en selectieve affiniteit voor het synaptisch vesikeleiwit 2A. Uit placebo-gecontroleerd onderzoek bleek het middel als add-on therapie effectiever dan placebo. Er is geen direct vergelijkend onderzoek uitgevoerd tussen brivaracetam en levetiracetam. De indirecte vergelijking gaf aan dat er geen statistisch significant verschil is in effectiviteit voor alle doses van brivaracetam en levetiracetam. Brivaracetam wordt in het algemeen goed verdragen. Het kent tot nu toe geen interacties. Bij nierfunctiestoornissen hoeft de dosis, in vergelijking met levetiracetam, niet aangepast worden – dit in tegenstelling tot leverfunctiestoornissen. De mogelijke winst is dan ook gelegen in deze eigenschap. Het is een geneesmiddel, waarvoor specialistische kennis noodzakelijk is. Geconcludeerd mag worden dat brivaracetam een toegevoegde waarde kan hebben bij de behandeling van partiële epilepsie als adjuvante therapie, waarbij duidelijke meerwaarde ten opzichte van levetiracetam niet kon worden aangetoond. Had fabrikant UCB Pharma BV, met het verlopen van het patent van levetiracetam, een nieuwe blockbuster voor ogen? Mede vanwege de prijs is brivaracetam een middel van tweede keus als add-on bij de behandeling van partiële epilepsie. De toekomst zal uitwijzen of het een eerstekeusmiddel wordt.
Literatuur
1. www.nationaalkompas.nl
2. www.farmacotherapeutischkompas.nl
3. Deckers CLP et al. Op zoek naar rationele polytherapie: Welke combinaties van anti-epileptica bieden meer effectiviteit dan andere? Ned Tijd Epileptologie 2001;29:35-51.
4. SMPC-tekst brivaracetam: http://www.ema.europa.eu/docs/nl_NL/document_library/EPAR_-_Product_Information/human/003898/WC500200206.pdf
5. http://tdm-monografie.org/Media/Default/Monografieen/TDM%20Levetiracetam%20091104.pdf
6. Lattanzi S et al. Brivaracetam add-on for refractory focal epilepsy: A systematic review and meta analysis. Neurology 2016 Apr 5;86(14):1344-1352.
7. Zhang L et al. Levetiracetam vs. brivaracetam for adults with refractory focal seizures: A meta-analysis and indirect comparison. Seizure 2016 Jul;39:28-33.