Samenvatting
Met de komst van alectinib en osimertinib zijn de vooruitzichten voor patiënten met niet-kleincellig longcarcinoom (NSCLC), onder de vorm van adenocarcinoom met EGFR-mutaties en ALK-translocaties, verbeterd. Zowel alectinib (Alecenca®) als osimertinib (Tagrisso®) hebben in fase 3-studies aangetoond de progressievrije overleving te verlengen. Hier staat wel een forse prijs tegenover: een behandeling van zesduizend euro per maand is geen uitzondering. De nieuwe generatie tyrosinekinaseremmers, waar alectinib en osimertinib onder vallen, penetreren de bloed-hersenbarrière beter en geven derhalve een betere intracraniële respons. Aangezien een deel van de patiënten met een EGFR-mutatie, en in het bijzonder met een ALK-translocatie, bij diagnose reeds hersenmetastasen heeft of krijgt in het beloop van hun ziekte, is de verwachting dat deze nieuwe middelen eerder in de behandeling van NSCLC worden ingezet.
J.J.M. Coremans, J.J.A.O. Schoenmaekers en L.I. van de Ven, onder medeverantwoordelijkheid van de redactie *
* Janna Schoenmaekers is longarts in het Maastricht UMC+, Liesbeth van de Ven en Jan Coremans zijn apothekers, eveneens werkzaam in het MUMC+.
Abstract
The availability of alectinib and osimertinib has improved the prognosis of patients with non-small-cell lung carcinoma (NSCLC), adenocarcinomas with mutations of epidermal growth factor receptor (EGFR) and translocations of anaplastic lymphoma kinase (ALK). Both alectinib (Alcenca®) and osimertinib (Tagrisso®) improved progression-free survival in phase III studies, but at a cost. Treatment is expensive – 6000 euros per month is not unusual. These new-generation tyrosine kinase inhibitors penetrate the blood-brain barrier better and give a better intracranial response. Because some patients with an EGFR mutation, and an ALK translocation in particular, already have brain metastases at diagnosis or will develop them during the course of the disease, it is anticipated that these new agents will be started earlier in the course of treatment for NSCLC.
Pharma Selecta 2017 (juli-aug) Pharm Sel 2017;33:56-59.
Inleiding
In 2016 zijn in Nederland 12.168 patiënten gediagnosticeerd met longkanker.[1] Ongeveer tachtig procent hiervan had het niet-kleincellig longcarcinoom (NSCLC) en ongeveer twintig procent het kleincellig longcarcinoom (SCLC).[2] Van de gehele patiëntengroep heeft bij diagnose ongeveer de helft reeds gemetastaseerde ziekte (stadium IV).
Bij het NSCLC worden er steeds meer moleculaire kenmerken ontdekt die weer leiden tot groei van targeted agents, zoals de tyrosinekinaseremmers (TKI’s). Belangrijke voorbeelden zijn de epidermale groeifactorreceptor (EGFR)-mutaties en de anaplastic lymphoma kinase (ALK)-translocaties. Een groot deel van de patiënten met een EGFR-mutatie, in het bijzonder met een ALK-translocatie, heeft bij diagnose al hersenmetastasen of krijgt deze in het verloop van hun ziekte.[3,4]
De eerste generatie TKI’s, zoals erlotinib en crizotinib, penetreren de bloed-hersenbarrière niet goed en hebben daarom geen goede intracraniële respons. De nieuwe generatie TKI’s, zoals alectinib en osimertinib, doordringen de bloed-hersenbarrière beter en geven derhalve een betere intracraniële respons.[4,5]
In Nederland worden patiënten met gemetastaseerd NSLC-adenocarcinoom standaard getest op mutaties. Als er een mutatie aanwezig is, kan gerichte therapie worden gegeven met een beter prognostisch beloop, in tegenstelling tot de normale chemotherapie. Afhankelijk van de patiënt en de mutatie zal dit een eerste of tweede generatie TKI zijn. De derde generatie TKI’s worden vooralsnog gegeven op het moment dat progressie ontstaat tijdens de eerstelijnstherapie. Indien dit het geval is, zal er worden gezocht naar een resistentiemechanisme (zoals T790M). Als bij een EGFR-mutatie de laatstgenoemde resistentie optreedt, kan als tweede lijn osimertinib (Tagrisso®) worden gegeven. In het geval van een ALK-mutatie komt, bij progressie, de patiënt in aanmerking voor het recent geregistreerde alectinib (Alecenca®).
Naar aanleiding van de resultaten van de hieronder belichte recente studies, zullen in de nabije toekomst de richtlijnen waarschijnlijk worden aangepast.
In dit artikel zal de plaats van alectinib en osimertinib bij NSCLC worden besproken.
Farmacodynamiek
Alectinib is een ALK- en RET-positieve tyrosinekinaseremmer. Remming van de ALK-tyrosinekinaseactiviteit leidt tot blokkering van daaropvolgende signaalroutes, waaronder STAT 3 en PI3K/AKT en de inductie van tumorceldood. Alectinib vertoont activiteit tegen mutante vormen van het ALK-enzym, waaronder mutaties die verantwoordelijk zijn voor de resistentie tegen crizotinib. De belangrijkste metaboliet van alectinib, M4, heeft in vitro vergelijkbare activiteit getoond. Alectinib is geen substraat van p-glycoproteïne of breast cancer resistance protein (BCRP), die beide effluxtransporters zijn in de bloed-hersenbarrière en kan zich daarom verspreiden in het centraal zenuwstelsel.[6]
Osimertinib is een EGFR-positieve tyrosinekinaseremmer. Het middel is een irreversibele remmer van EGFR met sensibiliserende mutaties (EGFRm) en de TKI-resistente mutatie T790M. Dit leidt tot remming van de celgroei.[7] Bij niet-kleincellige longkanker heeft 40% van de Aziatische patiënten en 10-15% van de blanke patiënten met NSCLC de T790-mutatie.
Farmacokinetiek
Alectinib – Na orale toediening van alectinib is de biologische beschikbaarheid niet-nuchter 37%. Vetrijk voedsel verhoogt de blootstelling aan alectinib en de actieve metaboliet M4 ongeveer drievoudig. Alectinib wordt voor 40-50% gemetaboliseerd door CYP3A4 tot de actieve metaboliet M4. Andere CYP-enzymen en aldehydehydrogenase metaboliseren tot de metabolieten M1b en M1a. Het wordt voor meer dan 98% uitgescheiden met de feces, waarvan 84% in onveranderde vorm. De eliminatiehalfwaardetijden van alectinib en M4 zijn 33 respectievelijk 31 uur.
Osimertinib – De biologische beschikbaarheid van osimertinib is 70% en wordt niet in klinisch significante mate beïnvloed door voedsel. Het wordt hoofdzakelijk gemetaboliseerd door oxidatie door CYP3A4, CYP3A5 en dealkylatie. De metaboliet AZ7550 is even actief als osimertinib; de metaboliet AZ5104 is actiever. Beide metabolieten vertegenwoordigen ongeveer 10% van de blootstelling aan osimertinib. Osimertinib wordt voor ongeveer 68% uitgescheiden met de feces, waarvan 1% onveranderd en voor ongeveer 14% met de urine, waarvan ongeveer 1% onveranderd. De eliminatiehalfwaardetijd is ongeveer 48 uur.
TDM – Therapeutic drug monitoring (TDM) wordt vooralsnog niet geadviseerd. TDM bij alectinib lijkt echter zinvol aangezien een vetrijke maaltijd de biologische beschikbaarheid verdrievoudigt.
Klinisch onderzoek
Alectinib
Er zijn verschillende onderzoeken gedaan met alectinib. Het fase 3-onderzoek ALEX is een vergelijkende studie met alectinib, gesponsord door F. Hoffmann-La Roche.[4] In dit gerandomiseerde, open-label onderzoek werd alectinib vergeleken met crizotinib – de huidige keuze bij patiënten met ALK-positief gevorderd NSCLC. Er werden 303 patiënten met gevorderd ALK-positief NSCLC 1:1 gerandomiseerd naar een behandeling met tweemaal daags 600 mg alectinib of tweemaal daags 250 mg crizotinib – rekening houdend bij de randomisatie met aanwezigheid van metastasen in het centraal zenuwstelsel. Het primaire eindpunt was de door de onderzoeker beoordeelde progressievrije overleving. De progressievrije overleving (twaalf maanden overleving) was significant hoger in de alectinibgroep: 68,4% (95% BI 61,0-75,9) in vergelijking met 48,7% in de crizotinibgroep (95% BI 40,4-56,9) met een HR van 0,47. De mediane gemiddelde progressievrije overleving was niet bereikt in alectinibgroep op het tijdstip van 17,7 maanden, vergeleken met de crizotinibgroep (11,1 maanden; 95% BI 9,1-13,1). Dit was het tussentijds resultaat. De studie loopt door.
Osimertinib
Er zijn verschillende onderzoeken uitgevoerd met osimertinib. Een vergelijkende studie is het fase 3-onderzoek
AURA-3, waarin osimertinib wordt vergeleken met chemotherapie, gesponsord door Astra-Zeneca.[5] Dit werd uitgevoerd bij 419 patiënten met gevorderd T790M-positief NSCLC, dat was verergerd na een eerstelijnstherapie met een EGFR-tyrosinekinaseremmer. De patiënten werden 2:1 gerandomiseerd naar een behandeling met eenmaal daags 80 mg osimertinib of chemotherapie op basis van pemetrexed (500 mg/m2) in combinatie met carboplatine (AUC 5) of cisplatine (75 mg/m2) om de drie weken (in totaal zes cycli). Het eindpunt in deze studie was de progressievrije overleving. De gemiddelde progressievrije overleving was significant langer met osimertinib dan met de pemetrexedtherapie: 10,1 maanden versus 4,4 maanden; HR 0,30 (95% BI 0,23-0,41; p<0,001).
Een vergelijking met de huidige eerstelijnstherapie bij de EGFR-positieve mutatie bij gevorderd NSCLC bij niet behandelde patiënten, loopt op dit moment. In dit fase 3, dubbelblinde, gerandomiseerde onderzoek FLAURA wordt de effectiviteit en veiligheid van osimertinib vergeleken met gefitinib en erlotinib.
Bijwerkingen
Alectinib – De meest voorkomende bijwerkingen van alectinib (>10%) waren anemie en visusstoornissen. Bij meer dan 10% trad diarree, braken, obstipatie, misselijkheid, verhoogd ASAT, ALAT en bilirubine, huiduitslag, spierpijn, verhoogd creatine fosfokinase in het bloed en oedeem op. Bij 1-10% kwam bradycardie en verhoogd creatinine in het bloed voor. Bij minder dan 1% interstitiële longziekte, pneumonitis en geneesmiddel geïnduceerde leverschade.
Osimertinib – De meest voorkomende bijwerkingen van osimertinib (>10%) waren diarree, stomatitis, keratitis, rash, droge huid, paronychia en pruritus. Bij 1-10% trad interstitiële longaandoening of pneumonitis op. Het werd gemeld bij 3,5% van de patiënten en was fataal bij 0,6%. Bij patiënten van Japanse afkomst was de incidentie van interstitiële longaandoening of pneumonitis 8,2%. Bij minder dan 1% trad verlenging van het QTc-interval op.
Beide geneesmiddelen zijn onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden.
Interacties
Alectinib wordt voor 40-50% door CYP3A4 gemetaboliseerd tot de actieve metaboliet M4 en door andere CYP-enzymen tot andere metabolieten (M1b en M1a). Interactie met CYP-3A4-inductoren en inhibitoren valt te verwachten. De mogelijke interacties zijn nog niet beoordeeld.
Osimertinib is substraat van CYP3A4 en remt BCRP. De plasmaconcentratie daalt door inductoren. De plasmaconcentratie van rosuvastatine stijgt. Voorzichtigheid is geboden bij combinatie met matige CYP3A4-inductoren, zoals bosentan, efavirenz, etravirine en modafinil. Bij combinatie met middelen die het QTc-interval verlengen, wordt periodieke ECG-controle aanbevolen.
Contra-indicaties
Alectinib is gecontraïndiceerd bij overgevoeligheid. Het wordt ontraden bij matige tot ernstige leverfunctiestoornissen vanwege het ontbreken van gegevens.
Osimertinib is gecontraïndiceerd bij overgevoeligheid. Het wordt ontraden bij ernstige leverfunctiestoornis wegens het ontbreken van gegevens. Voorzichtigheid is geboden bij congestief hartfalen en elektrolytstoornissen vanwege verlenging van het QTc-interval. Er wordt een periodieke ECG-controle aanbevolen.
Zwangerschap en lactatie
Gebruik van alectinib en osimertinib tijdens de zwangerschap en borstvoeding wordt ontraden. Vrouwen moeten tijdens en tot ten minste twee maanden na het einde van de behandeling contraceptieve maatregelen nemen; mannen tot vier maanden na het einde van de behandeling.
Het is niet bekend of de stoffen overgaan in de moedermelk. In dierproeven is dit wel aangetoond.[4]
Handelspreparaten, doseringen en prijzen
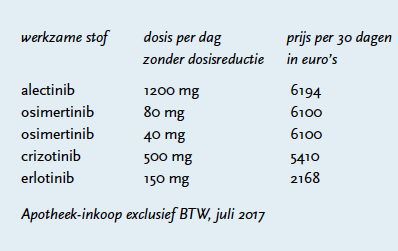
Alectinib is door de firma Roche op de markt gebracht onder de naam Alecenca® in capsules van 150 mg. Volwassenen starten aanvankelijk met tweemaal daags 600 mg. In geval van bijwerkingen kan een dosisreductie toegepast worden aan de hand van de CTC-AE-graad (NCI Common Terminology Criteria for Adverse Events). De dosering wordt dan tweemaal daags 450 mg. Indien nodig kan er een tweede dosisreductie plaatsvinden – dan wordt de dosering tweemaal daags 300 mg.
Osimertinib is door de firma AstraZeneca op de markt gebracht onder de naam Tagrisso® in tabletten van 40 of 80 mg. Volwassen starten met eenmaal daags 80 mg. In geval van bijwerkingen kan een dosisreductie uitgevoerd en wordt de dosering eenmaal daags 40 mg.
Voorlichting aan patiënt
Alectinib – De capsule dagelijks, met een tussenpoos van twaalf uur, op dezelfde tijdstippen innemen met voedsel tijdens ontbijt en diner; niet met een vetrijke en calorierijke maaltijd. De capsules niet openen of oplossen. Bij omissie kan de dosis ingehaald worden, tenzij er minder dan zes uur rest tot de volgende geplande dosis. Geen dubbele dosis innemen. Bij braken na inname, de inname niet herhalen, maar continueren vanaf volgende geplande dosis.
Osimertinib – Tablet dagelijks op hetzelfde tijdstip geheel innemen met water (niet breken, delen, verpulveren of kauwen), consequent met of zonder voedsel. Bij slikproblemen de tablet oplossen in 50 ml niet-koolzuurhoudend water: tablet geheel toevoegen aan het water en roeren tot uiteenvallen. Indien een tablet verloren gaat ten gevolge van overgeven, de inname niet herhalen. Inhalen van een gemiste dosis is toegestaan bij minder dan twaalf uur afwijking van het geplande tijdstip. Geen dubbele dosis innemen om een omissie te compenseren.
Conclusie
Met de introductie van alectinib en osimertinib zijn de vooruitzichten van patiënten met NSCLC-adenocarcinoom met EGFR-mutaties en ALK-translocaties verbeterd. Zowel alectinib als osimertinib hebben in fase 3-onderzoeken aangetoond de progressievrije overleving te verlengen. De ALEX-studie met alectinib laat een relatief lange overlevingsduur zien, met een gemiddelde progressievrije overleving van zeventien maanden en mogelijk langer. Hier staat wel een forse prijs tegenover: een behandeling van zesduizend euro per maand is geen uitzondering. Beide middelen zijn niet opgenomen in het GVS. Het is door de Nederlandse Zorgautoriteit aangewezen als add-on geneesmiddel. Qua verdraagzaamheid zijn beide middelen vergelijkbaar met andere tyrosinekinaseremmers, waarbij ook interstitiële longaandoeningen zijn gemeld.
De nieuwe generatie TKI’s, waaronder alectinib en osimertinib, penetreren de bloed-hersenbarrière beter en geven derhalve een betere intracraniële respons. Aangezien een deel van de patiënten met een EGFR-mutatie, met name met een ALK-translocatie, bij diagnose reeds hersenmetastasen heeft of krijgt in het beloop van hun ziekte, is de verwachting dat deze middelen vroeger in de behandeling van NSCLC worden ingezet.
Literatuur
1. Integraal kankercentrum Nederland. Cijfers over kanker 2017 [cited 2017 March 1]. http://www.cijfersoverkanker.nl/selecties/Dataset_1/img58b694d689191.
2. SEER database: SEER Stat Fact Sheets: Lung and Bronchus Cancer, Percent of Cases & 5-Year Relative Survival by Stage at Diagnosis: Lung and Bronchus Cancer [Internet]. Available from: http://seer.cancer.gov/statfacts/html/lungb.html.
3. Yawn BP, Wollan PC, Schroeder C, Gazzuola L, Mehta M. Temporal and gender-related trends in brain metastases from lung and breast cancer. Minn Med 2003;86(12):32-37.
4. Peters S, Camidge DR, Shaw AT, Gadgeel S, Ahn JS, Kim DW et al. Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2017 June 6.
5. Mok TS et al. AURA3 Investigators. Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer. N Engl J Med 2017 Feb 16;376(7):629-640.
6. SmPC Alecensa. Februari 2017.
7. SmPC Tagrisso. Februari 2017.