Samenvatting
Psoriasis is een chronische, immunologische aandoening die vooral de huid en de gewrichten aantast. In de afgelopen twintig jaar zijn er diverse biologicals geregistreerd voor de behandeling van deze aandoening, waaronder interleukine (IL)-17-remmers. Brodalumab (Kyntheum®) is, na ixekizumab en secukinumab, de derde IL-17-remmer die in Nederland is geregistreerd voor de behandeling van matige tot ernstige plaque psoriasis bij volwassen patiënten. Uit gerandomiseerd en gecontroleerd onderzoek blijkt het effectief. Twee netwerk-meta-analyses geven bovendien aan dat IL-17-remmers, waaronder brodalumab, effectiever zijn dan de TNF-alfa-antagonisten adalimumab en etanercept en de IL-12/23-remmer ustekinumab. Een nadeel van brodalumab ten opzichte van de andere IL-17-remmers is het kortere doseringsinterval van de subcutane injectie: eenmaal per twee weken versus eenmaal per vier weken. De behandeling is kostbaar en de prijs is nog eens circa tien procent hoger dan die van ixekizumab en secukinumab. Meer en langer durend onderzoek is nodig om de veiligheid op de lange termijn te beoordelen. Daarnaast dient brodalumab direct te worden vergeleken met andere IL-17-remmers, toegepast bij psoriasis. Vooralsnog lijken er geen voordelen te zijn boven de IL-17-remmers die al op de markt zijn.
A. Heersche en M.M.M. Geleedst-de Vooght, onder medeverantwoordelijkheid van de redactie
Abstract
Psoriasis is a chronic immunological condition that mainly affects the skin and joints. Over the last 20 years a number of biological agents have been registered as treatment for the condition, such as interleukin (IL)-17 inhibitors. Brodalumab (Kyntheum®) is the third IL-17 inhibitor after ixekizumab and secukinumab approved in the Netherlands for the treatment of moderate to severe plaque psoriasis in adults. Randomised and controlled studies have shown it to be effective. Two network meta-analyses have shown that IL-17 inhibitors, including brodalumab, are more effective than the TNF-alfa antagonists adalimumab and etanercept and the IL-12/23 inhibitor ustekinumab. A disadvantage of brodalumab compared with the other IL-17 inhibitors is its shorter dosing interval of the subcutaneous injections – once every 2 weeks instead of once every 4 weeks. Treatment is expensive, about 10% more expensive than treatment with ixekizumab or secukinumab. More and longer trials are needed to establish its long-term safety and to make head-to-head comparisons with other IL-17 inhibitors used to treat psoriasis. At the current time, brodalumab does not appear to be better than existing IL-17 inhibitors.
Pharma Selecta 2018 (juni) Pharm Sel 2018;34:46-50.
Inleiding
Brodalumab is in juli 2017 door de EMA geregistreerd onder de naam Kyntheum® voor systemische behandeling van matige tot ernstige plaque psoriasis bij volwassen patiënten.[1] Brodalumab is een interleukineremmer, gericht tegen de interleukine-17 receptor A (IL-17RA). Andere IL-17-remmers die in Nederland zijn geregistreerd voor deze indicatie zijn ixekizumab en secukinumab; deze zijn eerder in Pharma Selecta besproken.[2] Hierna volgt eerst een overzicht van psoriasis en de behandeling ervan, daarna wordt dieper ingegaan op de belangrijkste farmacologische kenmerken van brodalumab en de resultaten van klinisch effectiviteitsonderzoek.
Psoriasis
Inleiding
Psoriasis is een chronische, immunologische aandoening die vooral de huid en de gewrichten aantast. De prevalentie wereldwijd is naar schatting 2-3%. De meest voorkomende vorm is plaque psoriasis, ook wel psoriasis vulgaris genoemd. Circa 90% van de psoriasispatiënten heeft deze vorm. Psoriasis arthritis (PsA) is een veel voorkomende co-morbiditeit, die bij circa 20-30% van de patiënten voorkomt. Waarschijnlijk gaat psoriasis ook gepaard met een verhoogd risico op cardiovasculaire en psychiatrische aandoeningen. Psoriasis heeft een sterke genetische component.[3,4,5] De huidafwijkingen van plaque psoriasis uiten zich in scherp begrensde, rode, verdikte en schilferende huidplekken die voornamelijk op de extremiteiten, hoofd en romp voorkomen. De schilfers zijn vaak zilvergrijs van kleur. Daarnaast komen bij ongeveer de helft van de patiënten nagelafwijkingen voor, waaronder putjes, verdikking, onycholyse (loslaten van het nagelbed) en leukonychia (witte vlekken).[3]
Pathogenese
Psoriasis kenmerkt zich door een abnormale en versnelde proliferatie van keratinocyten en infiltratie van immunologische cellen in de dermis en epidermis. Er is sprake van disregulatie in zowel het aangeboren als het verworven immuunsysteem. De exacte oorzaak is nog onbekend.[3,4]
Mogelijk worden door een combinatie van genetische aanleg en invloeden van buitenaf keratinocyten getriggerd tot het produceren van antimicrobiële peptiden, waaronder cathelicidine (LL-37). Cathelicidine vormt een complex met lichaamseigen nucleotiden. Dit complex wordt herkend door dermale plasmacytoïde dendritische cellen. Deze cellen gaan na activatie grote hoeveelheden van de ontstekingsmediator interferon (IFN)-alfa produceren. INF-alfa versterkt de pro-inflammatoire respons van keratinocyten. Daarnaast zet INF-alfa de myeloïde dendritische cellen aan tot productie van grote hoeveelheden tumor necrose factor (TNF)-alfa, interleukine (IL)-12 en IL-23. TNF-alfa is een krachtig pro-inflammatoir cytokine en induceert activatie van secundaire mediatoren en adhesiemoleculen. IL-12 stimuleert de T-helper (Th) 1-respons. IL-23 activeert Th-17-cellen, dit zijn T-lymfocyten met expressie van een IL-23 receptor. Geactiveerde Th-17-cellen produceren veel pro-inflammatoire cytokinen waaronder IL-17, IL-20, IL-21 en IL-22. Deze cytokines induceren proliferatie van keratinocyten en andere klinische verschijnselen van psoriasis. IL-17 cytokines worden niet alleen door Th-17-cellen geproduceerd, maar ook door CD4+ T-cellen, epidermale CD8+ T-cellen, neutrofielen, mestcellen en macrofagen. Deze brede productie van IL-17 verklaart waarschijnlijk de effectiviteit van geneesmiddelen die op IL-17 aangrijpen. Zowel de route via TNF-alfa als via IL-23/Th-17 veroorzaken uiteindelijk een abnormale activatie en proliferatie van keratinocyten. De geactiveerde keratinocyten produceren ook weer cytokinen, chemokines en antimicrobiële peptiden. Het uiteindelijke gevolg is een vicieuze cirkel van ontsteking in de huid.[3,4,5]
Behandeling
De behandeling van plaque psoriasis is afhankelijk van een aantal factoren, zoals de vorm en ernst van de psoriasis en de hoeveelheid aangedaan huidoppervlak. Daarnaast spelen individuele factoren een rol, bijvoorbeeld leeftijd, ervaringen met voorafgaande behandelingen en de aanwezigheid van co-morbiditeiten zoals PsA en cardiovasculaire aandoeningen.[3,5]
Lokale behandeling
Lokale behandeling van psoriasis vindt vaak plaats met corticosteroïden en vitamine-D-analogen. In de tweede lijn worden ook topicale calcineurineremmers (tacrolimus en pimecrolimus) toegepast, maar deze zijn in Nederland niet voor psoriasis geregistreerd. Daarnaast zijn indifferente middelen belangrijk. Deze kunnen de huid hydrateren en de huidirritatie, jeuk en schildering verminderen.[3,5,6]
Lichttherapie
Lichttherapie kan worden ingezet bij matige tot ernstigere vormen van psoriasis of als lokale behandeling onvoldoende effectief dan wel niet praktisch is. Hiervoor gebruikt men meestal UVB-lichtbehandeling. UVA-lichtbehandeling in combinatie met de toediening van psoralenen (PUVA) wordt nauwelijks meer voorgeschreven.[3,5]
Systemische behandeling
Er zijn verschillende systemische behandelmogelijkheden. De orale middelen methotrexaat, ciclosporine, fumaraten en acitretine behoren tot de meer conventionele middelen. Methotrexaat wordt het langst toegepast bij de systemische behandeling van psoriasis en is effectief gebleken. Ciclosporine is een zeer effectieve therapie bij psoriasis met een snelle werkingsinzet, maar kent ook veel bijwerkingen, waaronder nefrotoxiciteit. De richtlijn Psoriasis van de Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) raadt daarom aan om dit middel te reserveren als kortdurende therapie voor het induceren van een remissie en het in ieder geval niet langer dan twee jaar te gebruiken. Acitretine, een retinoïd, is vooral in combinatietherapie effectief, maar heeft het nadeel van teratogeniteit in combinatie met een zeer langzame eliminatie uit het lichaam. Vrouwen in de vruchtbare leeftijd mogen tot drie jaar na staken van het middel niet zwanger worden.[3,5]
Apremilast is een fosfodiësterase (PDE)-4-remmer, die sinds enkele jaren geregistreerd is voor de behandeling van psoriasis. Het heeft echter een lage effectiviteit vergeleken met methotrexaat, ciclosporine en de biologicals. De NVDV-richtlijn Psoriasis geeft aan dat men apremilast kan overwegen bij patiënten met een sterke voorkeur voor een oraal middel, voordat een biological wordt gestart.[3,5]
In de afgelopen twintig jaar zijn er diverse biologicals geregistreerd voor de behandeling van psoriasis. Biologicals zijn geneesmiddelen die bestaan uit natuurlijke eiwitten zoals antilichamen en cytokines, of fragmenten van eiwitten of synthetische peptiden. De biologicals die worden toegepast bij psoriasis, grijpen op verschillende componenten van het immuunsysteem aan. Etanercept is een TNF-alfa-antagonist. Infliximab, adalimumab en certolizumab pegol zijn anti-TNF-antilichamen, gericht tegen TNF-alfa Ze binden specifiek aan TNF-alfa en neutraliseren de biologische functie ervan door de interactie van TNF-alfa met TNF-receptoren op het celoppervlak te blokkeren. Ustekinumab is een IL-12- en IL-23-remmer. Guselkumab is een IL-23-remmer. Brodalumab, ixekizumab en secukinumab zijn IL-17-remmers. Ixekizumab en secukinumab binden aan het cytokine IL-17A, brodalumab bindt aan de IL-17 receptor A. Biologicals zijn zeer effectief gebleken bij de behandeling van psoriasis, maar een nadeel is dat de patiënt ze via een subcutane injectie moet toedienen.[3,5,7]
Brodalumab
Farmacologie
Dynamiek
Brodalumab is een recombinant, humaan monoklonaal antilichaam dat met hoge affiniteit bindt aan de interleukine-17 receptor A (IL-17RA). Hierdoor blokkeert brodalumab de binding en daarmee de biologische activiteit van de pro-inflammatoire cytokinen IL-17A, IL-17F, IL-17A/F-heterodimeer en IL-25 aan de IL-17RA. Het gevolg is remming van de afgifte van ontstekingsmediatoren en daarmee afname van de ontsteking en de klinische symptomen van psoriasis.[1,7]
Kinetiek
De biologische beschikbaarheid na subcutane toediening bedraagt 55%. Na een enkelvoudige dosis wordt de Cmax bereikt na drie dagen. Het verdelingsvolume is ongeveer 7,2 liter. Brodalumab wordt op dezelfde manier als endogeen immunoglobuline via intracellulair katabolisme gemetaboliseerd in kleine peptiden en aminozuren. De eliminatiehalfwaardetijd bedraagt ongeveer elf dagen. Bovenstaande waarden zijn geschat op basis van een farmacokinetisch populatiemodel.[1]
Klinisch onderzoek
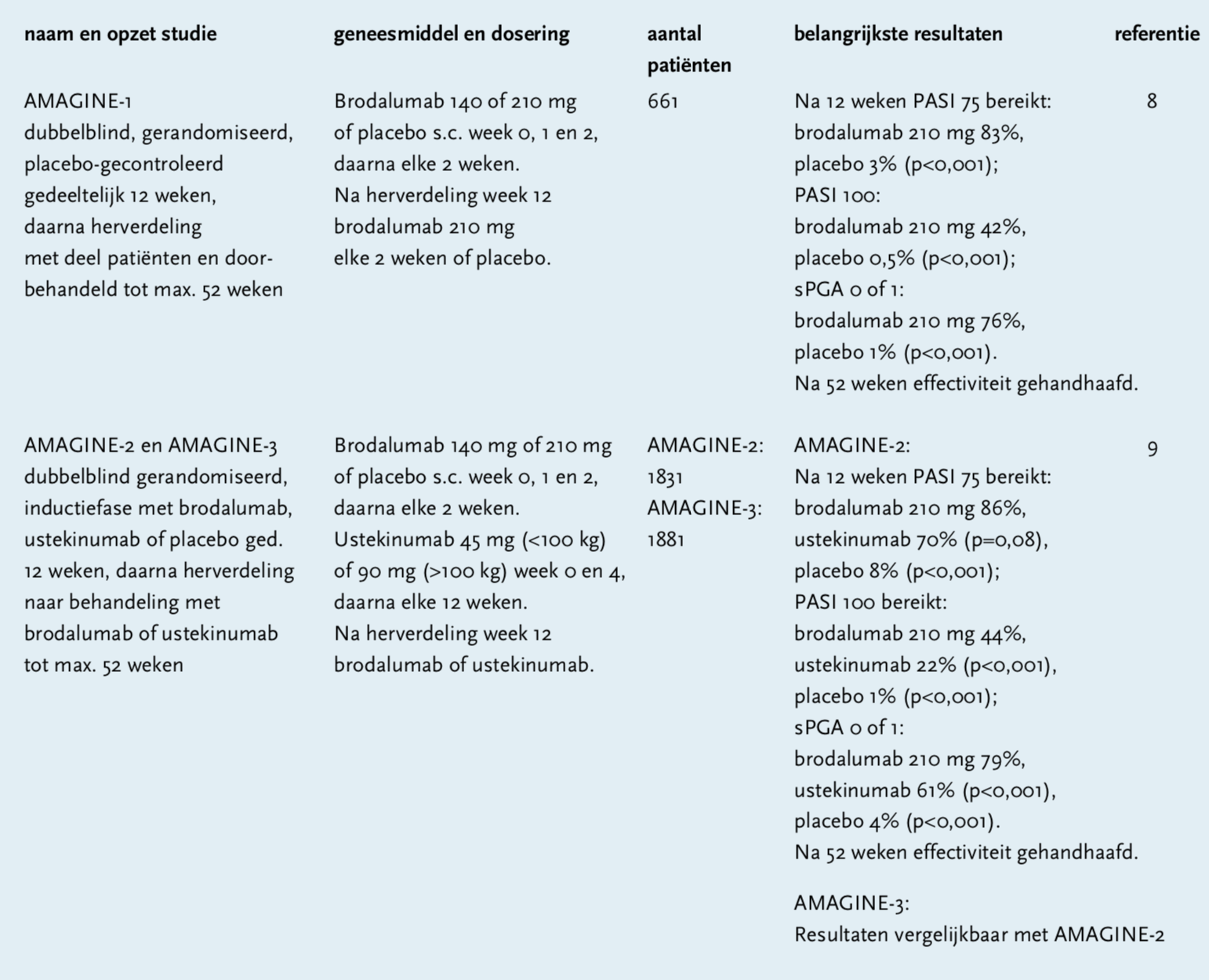
In klinische onderzoeken wordt de ziekteactiviteit van psoriasis vaak bepaald aan de hand van de Psoriasis Area and Severity Index (PASI). Deze loopt van 0 (geen verschijnselen) tot 72 (ernstige met roodheid, schilfering en verdikking over het hele lichaam). De effectiviteit van de behandeling wordt uitgedrukt in verbetering van de PASI-score. PASI 75 en PASI 90 worden het meest gebruikt. Ze geven een reductie aan van de verschijnselen van de aandoenig van ten minste 75 respectievelijk 90 procent. PASI 100 is een totale reductie. Een andere veel gebruikte maat voor de ziekteactiviteit is de static Physician’s Global Assessment (sPGA). Deze score varieert van 0 tot 5, waarbij 0 staat voor geen verschijnselen en 5 voor zeer ernstige.
Er zijn drie fase 3-onderzoeken naar de klinische effectiviteit van brodalumab verricht: AMAGINE-1, -2 en -3.[8,9] Deze studies zijn uitgevoerd onder patiënten met matige tot ernstige plaque psoriasis. In AMAGINE-1 waren de primaire eindpunten na twaalf weken het bereiken van PASI 75 en het bereiken van sPGA van 0 of 1 (brodalumab 140 en 210 mg versus placebo). In AMAGINE-2 en -3 waren de primaire eindpunten na twaalf weken het bereiken van PASI 75, sPGA van 0 of 1 (brodalumab 140 en 210 mg versus placebo) en het bereiken van PASI 100 (brodalumab 210 mg versus ustekinumab). De belangrijkste bevindingen uit deze studies staan in een tabel weergegeven.
Naast de fase 3-studies zijn er ook gegevens uit enkele netwerk-meta-analyses, waarbij verschillende geneesmiddelen, die toegepast worden bij psoriasis, met elkaar zijn vergeleken, waaronder brodalumab. De grootste hiervan is een Cochrane meta-analyse (109 studies, 39.882 patiënten met matige tot ernstige plaque psoriasis of PsA) die de effectiviteit en veiligheid van conventionele systemische geneesmiddelen (acitretine, ciclosporine, fumaraten en methotrexaat), apremilast en diverse biologicals, waaronder de IL-17-remmers secukinumab, ixekizumab en brodalumab, met elkaar vergeleek. Alle biologicals waren significant effectiever in het bereiken van de PASI 90 dan de conventionele systemische therapieën en apremilast. De drie IL-17-remmers en guselkumab waren significant effectiever in het bereiken van de PASI 90 dan de anti-TNF-alfa-remmers infliximab, adalimumab en etanercept. Het meest effectief (bereiken PASI 90 in vergelijking met placebo) was ixekizumab (risk ratio [RR] 32,45), gevolgd door secukinumab (RR 26,55), brodalumab (RR 25,45), certolizumab (RR 24,58) en ustekinumab (RR 19,91). Bij alle onderzochte geneesmiddelen verschilde het risico op ernstige bijwerkingen niet significant met placebo.[10]
Een andere meta-analyse (34 fase 3-studies, waarvan 26 placebo-gecontroleerd en acht direct vergelijkende studies) vergeleek acht immunomodulatoren toegepast bij psoriasis, waaronder brodalumab. Het meest effectief (bereiken van PASI 75 in vergelijking met placebo) was ixekizumab (RR 17,9), gevolgd door brodalumab (RR 17,3), infliximab (RR 16,2), secukinumab (RR 15,4), ustekinumab (RR 14,0), adalimumab (RR 13,0), etanercept (RR 9,6) en apremilast (RR 6,2). Ixekizumab, brodalumab en infliximab waren significant effectiever in het bereiken van de PASI 75 dan ustekinumab, adalimumab, etanercept en apremilast.[11]
Bijwerkingen
Het SmPC noemt als meest gemelde bijwerkingen van brodalumab gewrichtspijn (4,6% van de patiënten), hoofdpijn (4,3%), vermoeidheid (2,6%), diarree (2,2%) en orofaryngeale pijn (2,1%). Andere vaak voorkomende bijwerkingen (bij 1-10% van de patiënten) zijn griep, schimmelinfecties van de huid, neutropenie, misselijkheid, myalgie en reacties op de injectieplaats. Soms (0,1-1% van de patiënten) komen nasopharyngitis en Candida-infecties voor.[1]
In een open label verlenging van een fase 2-studie waren gedurende 120 weken gebruik van brodalumab de meest voorkomende bijwerkingen nasopharyngitis (bij 26,5% van de patiënten), infectie van de bovenste luchtwegen (19,9%), gewrichtspijn (16,0%) en rugpijn (11,0%).[12]
Interacties
Tijdens gebruik van brodalumab mag men geen levende vaccins toedienen. Vanwege de immunosuppressieve werking kan vaccinatie met levende micro-organismen een gegeneraliseerde infectie veroorzaken.[1,7]
Contra-indicaties
Overgevoeligheid voor het werkzame bestanddeel of voor een van de hulpstoffen is een contra-indicatie voor gebruik van brodalumab. Brodalumab verhoogt het risico op infecties door onderdrukking van de immuunrespons. Men moet daarom voorzichtig zijn met het gebruik bij patiënten met een infectie. Als een patiënt een ernstige infectie ontwikkelt, moet men brodalumab staken en pas weer continueren als deze is verdwenen.
Brodalumab is gecontraïndiceerd bij patiënten met actieve tuberculose of actieve ziekte van Crohn.
Het middel is niet onderzocht bij patiënten met een verminderde nier- of leverfunctie. De fabrikant geeft daarom geen aanbevelingen voor gebruik bij deze patiëntgroepen. Omdat brodalumab via intracellulair katabolisme wordt gemetaboliseerd, heeft een verminderde leverfunctie naar verwachting weinig invloed. De eliminatie via de nieren is vermoedelijk laag en van weinig invloed.[1]
Tijdens de fase 3-onderzoeken AMAGINE-1 en -2 pleegden enkele patiënten, die behandeld werden met brodalumab, suïcide. In een analyse van de klinische onderzoeken met brodalumab is geen causaal verband vastgesteld tussen gebruik van brodalumab en een verhoogd risico op suïcidaal gedrag.[13] Toch is in het SmPC een waarschuwing opgenomen om bij risicopatiënten alert te zijn op het ontstaan of verergeren van depressie, suïcidaal gedrag, angst of andere stemmingsveranderingen.[1]
Zwangerschap en lactatie
Er is weinig onderzoek gedaan naar gebruik van brodalumab tijdens de zwangerschap. Dieronderzoek bracht geen directe of indirecte schadelijke effecten aan het licht. Uit voorzorg wordt gebruik tijdens de zwangerschap afgeraden. Het is niet bekend of brodalumab wordt uitgescheiden in de moedermelk. Naar verwachting zal het wel in geringe concentraties in de moedermelk aanwezig zijn. Het advies is om indien mogelijk, het geven van borstvoeding en het gebruik van brodalumab niet te combineren.[1]
Voorlichting aan de patiënt
De patiënt moet brodalumab in principe bewaren in de koelkast, al kan het in de buitenverpakking tot veertien dagen buiten de koelkast bewaard blijven. De fabrikant adviseert om de injectiespuit minimaal dertig minuten voor toedienen uit de koelkast te halen zodat de injectievloeistof op kamertemperatuur is voordat deze wordt toegediend. Elke voorgevulde spuit is voor eenmalig gebruik en moet helemaal leeg gespoten worden. De spuit niet schudden voor gebruik.[1]
Handelspreparaten, dosering en prijs
Brodalumab wordt onder de naam Kyntheum® geleverd door de firma LEO Pharma BV. Brodalumab is verkrijgbaar als oplossing voor injectie in een voorgevulde spuit voor eenmalige toediening. Een injectie bevat 210 mg brodalumab in 1,5 ml oplosmiddel. Andere bestanddelen van de injectievloeistof zijn proline, glutamaat, polysorbaat 20 en water voor injecties.
De aanbevolen dosis is 210 mg, toe te dienen als subcutane injectie. De eerste drie keer eenmaal per week, daarna eenmaal per twee weken. Er is geen dosisaanpassing nodig bij oudere patiënten.[1]
De kosten van brodalumab liggen iets hoger dan die van de twee andere IL-17-remmers.[14]

Brodalumab is, net als ixekizumab en secukinumab, niet opgenomen in het geneesmiddelvergoedingssysteem (GVS). Het is door de Nederlandse Zorgautoriteit aangewezen als add-on geneesmiddel. Add-on geneesmiddelen kunnen door het ziekenhuis apart van de behandeling in rekening worden gebracht bij de zorgverzekeraar.[14]
Conclusie en plaatsbepaling
Uit gecontroleerd onderzoek blijkt brodalumab effectief bij de behandeling van matige tot ernstige plaque psoriasis bij volwassenen. Twee netwerk-meta-analyses geven aan dat IL-17-remmers, waaronder brodalumab, effectiever zijn dan de TNF-alfa-antagonisten adalimumab en etanercept en de IL-12/23-remmer ustekinumab. Er is echter nog weinig direct vergelijkend onderzoek met IL-17-remmers en andere biologicals uitgevoerd. Ook is brodalumab nog niet direct vergeleken met ixekizumab en secukinumab, de andere twee IL-17-remmers die voor psoriasis zijn geregistreerd.
De bijwerkingen van brodalumab zijn vergelijkbaar met die van ixekizumab en secukinumab. Er zijn nog weinig gegevens over de veiligheid op de lange termijn.
Een nadeel van brodalumab ten opzichte van de andere IL-17-remmers is het kortere doseringsinterval van de subcutane injectie: eens per twee weken versus eenmaal per vier weken. De kosten van de behandeling zijn hoog en de prijs van brodalumab ligt nog circa tien procent hoger dan die van ixekizumab en secukinumab. Brodalumab is momenteel niet opgenomen in het GVS. Het is door de Nederlandse Zorgautoriteit aangewezen als add-on geneesmiddel. Brodalumab blijkt effectief voor de behandeling van matige tot ernstige plaque psoriasis.
Voor de definitieve plaatsbepaling is meer onderzoek nodig om de veiligheid op de lange termijn te beoordelen en brodalumab direct te vergelijken met andere IL-17-remmers, toegepast bij psoriasis. Vooralsnog lijken er geen voordelen te zijn van brodalumab boven de IL-17-remmers die al op de markt zijn.
Literatuur
1. SmPC Kyntheum® (16-04-2018 geraadpleegd via http://www.ema.europa.eu).
2. Holsappel IGA, Stolk LML. Ixekizumab en secukinumab; uitbreiding van de HUIDige therapie bij plaque psoriasis. Pharm Sel 2016;32:53-55.
3. Greb JE, Goldminz AM, Elder JT, Lebwohl MG, Gladman DD, Wu JJ et al. Psoriasis. Nat Rev Dis Primers 2016;2:16082.
4. Boehncke WH, Schön MP. Psoriasis. Lancet 2015;386:983-994.
5. NVDV Multidisciplinaire evidence based richtlijn Psoriasis 2017 (geraadpleegd via http://www.nvdv.nl).
6. NHG-Standaard Psoriasis derde herziening 2014 (geraadpleegd via https://www.nhg.org).
7. Informatorium Medicamentorum. Inleidende tekst Middelen bij inflammatoire aandoeningen en Stofmonografie brodalumab. (geraadpleegd via https://kennisbank.knmp.nl op 17-04-2018.)
8. Papp KA, Reich K, Paul C, Blauvelt A, Baran W, Bolduc C et al. A prospective phase III, randomized, double-blind, placebo-controlled study of brodalumab in patients with moderate-to-severe plaque psoriasis. Br J Dermatol 2016;175:273-286.
9. Lebwohl M, Strober B, Menter A, Gordon K, Weglowska J, Puig L et al. Phase 3 Studies Comparing Brodalumab with Ustekinumab in Psoriasis. N Engl J Med 2015;373:1318-1328 and Supplementary Appendix.
10. Sbidian E, Chaimani A, Garcia-Doval I, Do G, Hua C, Mazaud C et al. Systemic pharmacological treatments for chronic plaque psoriasis: a network meta-analysis. Cochrane Database Syst Rev 2017;12:CD011535.
11. Loos AM, Liu S, Segel C, Ollendorf DA, Pearson SD, Linder JA. Comparative effectiveness of targeted immunomodulators for the treatment of moderate-to-severe plaque psoriasis: A systematic review and network meta-analysis. J Am Acad Dermatol 2018 Feb 10. pii: S0190-9622(18)30213-5 [Epub ahead of print].
12. Papp K, Leonardi C, Menter A, Thompson EH, Milmont CE, Kricorian G, Nirula A et al. Safety and efficacy of brodalumab for psoriasis after 120 weeks of treatment. J Am Acad Dermatol 2014;71:1183-1190.
13. Lebwohl MG, Papp KA, Marangell LB, Koo J, Blauvelt A, Gooderham M et al. Psychiatric adverse events during treatment with brodalumab: Analysis of psoriasis clinical trials. J Am Acad Dermatol 2018;78:81-89.
14. https://www.medicijnkosten.nl (geraadpleegd 26-05-2018).