Samenvatting
Calcitonine-gen gerelateerd peptide (CGRP) is een neuropeptide dat een rol speelt bij de ontstekingsprocessen en vasodilatatie die bij migraine plaatsvinden. Galcanezumab (Emgality®) is een tweede CGRP-receptorantagonist monoklonaal antilichaam, geregistreerd voor profylaxe van migraine bij volwassenen. In de placebo-gecontroleerde studies bleek galcanezumab ongeveer tweemaal zo effectief als placebo in de vermindering van het aantal migrainedagen per maand. Het was ook effectief bij patiënten die niet reageerden op eerdere profylaxebehandeling en bij chronische migraine. Voor een definitieve plaatsbepaling van galcanezumab is direct vergelijkend onderzoek nodig; daarnaast dienen de effectiviteit op de lange termijn en de veiligheid nog verder onderzocht te worden.
R.W.G. Bruggeman en M. Nagtegaal, onder medeverantwoordelijkheid van de redactie
Abstract
Calcitonin-gene related peptide (CGRP) is a neuropeptide that has a role in the inflammatory processes and vasodilatation that occur in migraine. Galcanezumab (Emgality®) is the second recombinant humanized monoclonal antibody against the CGRP receptor to be licensed for migraine prophylaxis in adults. In placebo-controlled trials, galcanezumab was roughly twice as effective as placebo in the prophylaxis of migraine, reducing the number of migraine days per month. It was effective in patients who were not responsive to previous prophylactic treatment and in those with chronic migraine. Head-to-head comparison studies are needed to determine its place in the treatment arsenal. In addition, long-term efficacy and safety need to be investigated.
Pharma Selecta 2019 (juni) Pharm Sel 2019;35:42-45.
Inleiding
Migraine is een neurovasculaire aandoening met heftige, aanvalsgewijze, eenzijdige hoofdpijn. Migraine is vaak familiair. Het heeft een prevalentie van circa 15% en komt vaker voor bij vrouwen dan bij mannen. De hoofdpijnaanvallen kunnen 4 tot 72 uur aanhouden, zijn vaak pulserend, verergeren bij inspanning en gaan vaak gepaard met misselijkheid en/of licht- en geluidsovergevoeligheid. Bij 15 tot 25% van de patiënten wordt de migraineaanval voorafgegaan door een aura. Onderscheid moet worden gemaakt tussen migraine en andere vormen van hoofdpijn, zoals spannings-, cluster- en medicatie-afhankelijke hoofdpijn.
Het doel van de behandeling is de aanvallen hanteerbaar en controleerbaar te maken door de ernst te verlichten en de duur ervan te verkorten. De voorkeur gaat uit naar paracetamol in een voldoende hoge dosering. Tweede keus, op grond van de bijwerkingen en werkzaamheid, zijn NSAID’s en triptanen. Zo nodig kan bij misselijkheid en braken, naast de pijnstiller, een anti-emeticum worden ingenomen. Bij twee of meer aanvallen per maand is profylaxe te overwegen. Eerste keus is een bètablokker en als tweede valproïnezuur of topiramaat. Candesartan, off-label, heeft soms in de tweedelijnszorg de voorkeur omdat dit middel minder bijwerkingen geeft, zodat hierdoor de behandeling niet hoeft te worden gestaakt.[1 2]
Calcitonine-gen gerelateerd peptide (CGRP) is een neuropeptide dat een rol speelt bij de ontstekingsprocessen en vasodilatatie die bij migraine plaatsvinden. Galcanezumab (Emgality®) is, met erenumab, het tweede CGRP-receptorantagonist monoklonale antilichaam, dat geregistreerd is voor profylaxe van migraine bij volwassenen die hier tenminste vier dagen per maand mee te maken hebben.[3-5] CGRP-antagonisten bieden mogelijk uitkomst aan patiënten die niet goed te behandelen zijn met de huidige medicatie of te veel last hebben van bijwerkingen.
Farmacodynamiek
Galcanezumab is een gehumaniseerd IgG4-monoklonaal antilichaam, geproduceerd in ovariumcellen van de Chinese hamster, dat zich aan het calcitonine-gen gerelateerd peptide bindt, waarmee het de biologische activiteit van CGRP voorkomt. Verhoogde bloedspiegels van CGRP zijn in verband gebracht met migraineaanvallen. Activatie van de CGRP-receptor zorgt voor vasodilatatie en moduleert nociceptieve pijnsignalering. Tijdens een migraineaanval neemt de CGRP-spiegel toe en deze normaliseert weer als de hoofdpijn afneemt. Galcanezumab bindt met hoge affiniteit en hoge specificiteit aan CGRP.[6]
Farmacokinetiek
De geschatte biologische beschikbaarheid na subcutane toediening bedraagt 82%. Op basis van een farmacokinetische populatieanalyse was na een oplaaddosis van 240 mg de maximale serumconcentratie (Cmax) van galcanezumab ongeveer 30 mcg/ml (27% variatiecoëfficiënt, VC) en de tijd tot Cmax was vijf dagen na toediening. Maandelijkse doses van 120 mg of 240 mg bereikten een steady-state Cmax van ongeveer 28 mcg/ml (35% VC) respectievelijk 54 mcg/ml (31% VC). De steady-state Cmax bij een maandelijkse dosis van 120 mg wordt bereikt na de oplaaddosis van 240 mg. Het verdelingsvolume bedraagt 7,3 liter. Galcanezumab wordt via katabole routes, op dezelfde wijze als endogeen IgG, in kleine peptiden en aminozuren afgebroken. De eliminatiehalfwaardetijd bedraagt 27 dagen.[6]
Klinische studies
De effectiviteit en veiligheid van galcanezumab is in drie gerandomiseerde, placebo-gecontroleerde, dubbelblinde fase 3-onderzoeken onderzocht bij volwassen patiënten.
In de EVOLVE-1-studie waren patiënten geïncludeerd die voldeden aan de criteria van de International Classification of Headache Disorders (ICHD) voor een diagnose migraine met of zonder aura met vier tot veertien dagen aan migraine gerelateerde hoofdpijn per maand. Patiënten met een voorgeschiedenis van acute cardiovasculaire voorvallen en/of een hoog risico daarop werden uitgesloten van deelname, evenals patiënten ouder dan 65 jaar. Het primaire eindpunt was de verandering in het aantal dagen met migrainehoofdpijn per maand (MHD) vanaf baseline tot maand zes van de behandeling. Secundaire eindpunten waren een vermindering van tenminste 50, 75 en 100% MHD, de vermindering van MHD’s met acute hoofdpijnmedicatie en reductie van de hoofdpijnscores, gemeten aan de hand van de Role Function-Restrictive domain van de Migrain-Specific Quality of Life Questionnaire (MSQ) en aan de hand van de Migraine Disability Assessment (MIDAS) vragenlijst. Met MSQ wordt de impact van migraine op het werk, dagelijkse activiteiten, relatie met familie en vrienden, vrije tijd, productiviteit, concentratie, energie en vermoeidheid gemeten. De scores lopen van 0 tot 100, waarbij een hogere score op minder functieverlies wijst, hetgeen betekent dat patiënten minder belemmeringen ervaren bij het doen van dagelijkse bezigheden. Respondenten voor MSQ werden gedefinieerd als degenen met een verbetering van meer dan 17,14 punten voor chronisch migraine op maand drie. In de MIDAS-vragenlijst betekent een hogere score een slechter functioneren. Patiënten kregen na een wash-out periode voor profylactische medicatie van 3 tot 45 dagen placebo, galcanezumab 120 mg/maand (met een oplaaddosis van 240 mg in de eerste maand) of galcanezumab 240 mg/maand per subcutane injectie gedurende zes maanden, en mochten daarnaast medicatie voor de acute behandeling van migraine gebruiken. Er werden in totaal 858 patiënten geïncludeerd. De gemiddelde leeftijd was 40,7 jaar en 83,7% was vrouw. Er ontvingen 213 patiënten 120 mg galcanezumab, 212 ontvingen 240 mg galcanezumab en 433 placebo. Patiënten behandeld met galcanezumab hadden een significante vermindering van het aantal migrainedagen per maand van -4,7 bij 120 mg (95%BI -2,48 tot -1,37; p<0,001) en -4,6 bij 240 mg galcanezumab (95%BI -2,31 tot -1,20; p<0,001) ten opzichte van placebo -2,8 dagen. Ook op secundaire eindpunten liet de behandeling met galcanezumab een verbetering zien ten opzichte van placebo (zie tabel 1).[7 8]
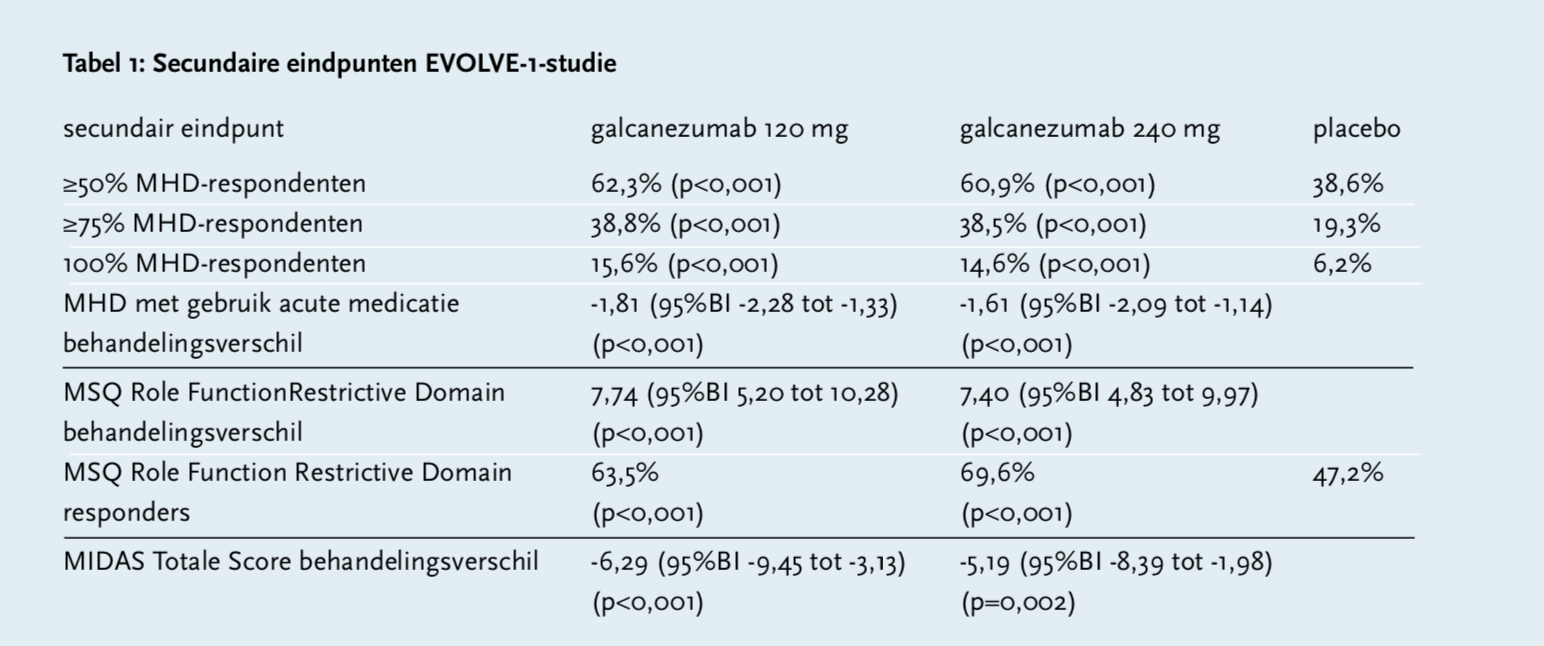
In het gerandomiseerde, placebo-gecontroleerde, dubbelblinde fase 3-onderzoek EVOLVE-2 werd galcanezumab onderzocht bij 915 patiënten. De opzet was gelijk aan de EVOLVE-1-studie. Het primaire eindpunt was de verandering in MHD vanaf baseline tot maand zes van de behandeling. Secundaire eindpunten waren: een vermindering van tenminste 50, 75 en 100% MHD, de vermindering van MHD met acute hoofdpijnmedicatie en reductie van de hoofdpijnscores. Er ontvingen 231 patiënten 120 mg galcanezumab, 223 ontvingen 240 mg galcanezumab en 461 placebo. Patiënten behandeld met galcanezumab hadden een significante vermindering van het aantal migrainedagen per maand: -4,3 bij 120 mg (95%BI -2,6 tot -1,5; p<0,001) en -4,2 bij 240 mg (95%BI -2,4 tot -1,4; p<0,001) ten opzichte van placebo -2,3 dagen. Ook op secundaire eindpunten liet de behandeling met galcanezumab een significante verbetering zien ten opzichte van placebo. Pijn op de injectieplaats en erythema waren de meest gerapporteerde bijwerkingen.[8 9]
In de dubbelblinde, placebo-gecontroleerde REGAIN-studie namen patiënten deel die aan de ICHD-criteria voor chronische migraine voldeden met vijftien of meer hoofdpijndagen per maand, waarvan er minstens acht de kenmerken van migraine hadden. Patiënten werden behandeld met galcanezumab gedurende drie maanden, gevolgd door een open-label verlenging van negen maanden. Patiënten met een voorgeschiedenis van acute cardiovasculaire voorvallen en/of een hoog risico hierop werden uitgesloten van deelname, alsmede patiënten ouder dan 65 jaar. Het primaire eindpunt was de verandering in het aantal MHD vanaf baseline tot maand drie van de dubbelblinde, placebo-gecontroleerde behandeling. Secundaire eindpunten waren een vermindering van tenminste 50, 75 en 100% MHD, de vermindering van MHD met acute hoofdpijnmedicatie en reductie van de hoofdpijnscores. Er werden in totaal 1113 patiënten geïncludeerd, de gemiddelde leeftijd was 40,8 jaar en 84,7% was vrouw met een gemiddelde MHD van 19,3 en een gemiddelde MIDAS-score van 65,8. Er ontvingen 278 patiënten 120 mg galcanezumab (met een eerste oplaaddosis van 240 mg in de eerste maand), 277 ontvingen 240 mg galcanezumab en 558 kregen placebo. Patiënten behandeld met galcanezumab hadden een significante vermindering van het aantal MHD: -4,8 dagen bij 120 mg (95%BI -2,9 tot -1,3; p<0,001) en -4,6 bij 240 mg galcanezumab (95%BI -2,7 tot -1,1; p<0,001) ten opzichte van placebo -2,7. Ook op secundaire eindpunten liet behandeling met galcanezumab een verbetering zien ten opzichte van placebo (zie tabel 2).[10]
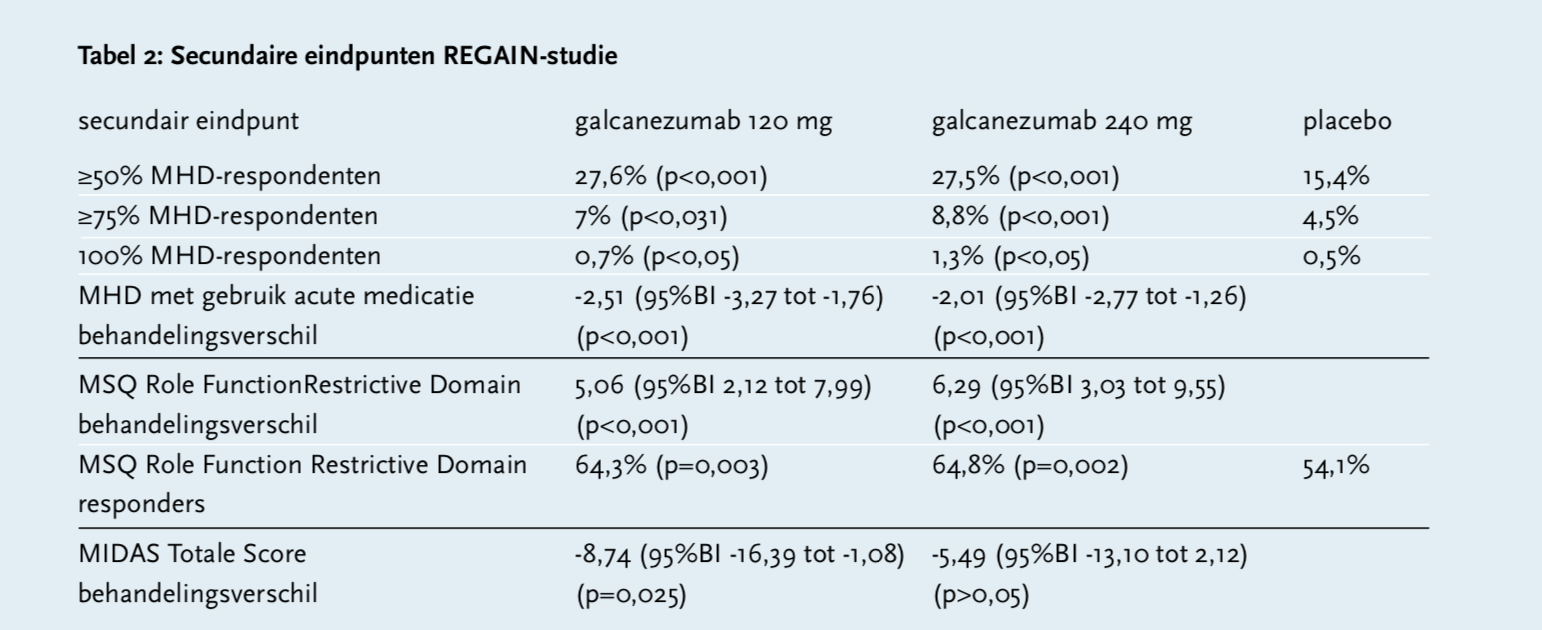
In de besproken onderzoeken werd geen klinisch relevant verschil waargenomen tussen de behandeling met 120 mg en 240 mg galcanezumab.
Bijwerkingen
De meest voorkomende bijwerkingen bij injecties met galcanezumab waren pijn op de injectieplaats (circa 10%), injectieplaatsreacties (circa 10%), duizeligheid (circa 1%), obstipatie (1,5%), pruritus (1%) en urticaria. De meeste reacties waren licht of matig. Minder dan 2,5% van de patiënten in deze onderzoeken staakten de behandeling vanwege bijwerkingen.[6]
Interacties
Er zijn geen interactiestudies uitgevoerd. Op basis van de kenmerken van galcanezumab worden geen farmacokinetische geneesmiddelinteracties verwacht.[6]
Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de hulpstoffen is een contra-indicatie. Er is geen dosisaanpassing nodig bij patiënten met een lichte tot matige nier- of leverfunctiestoornis. De veiligheid en werkzaamheid van galcanezumab bij kinderen tot 18 jaar en patiënten ouder dan 65 jaar is niet onderzocht.[6]
Zwangerschap en lactatie
Er is een beperkte hoeveelheid gegevens bekend over het gebruik van galcanezumab tijdens de zwangerschap. De resultaten van dieronderzoek duiden niet op directe of indirecte schadelijke effecten betreffende reproductietoxiciteit. Van humaan immunoglobuline (IgG) is bekend dat het de placentabarrière passeert. Uit voorzorg wordt gebruik van galcanezumab tijdens de zwangerschap afgeraden.[6]
Het is niet bekend of galcanezumab in de moedermelk wordt uitgescheiden. Van humaan IgG is bekend dat het gedurende de eerste dagen na de geboorte in de moedermelk wordt uitgescheiden. Het advies is dan ook om de eerste paar dagen na de geboorte geen borstvoeding te geven bij gebruik van galcanezumab. Daarna kan men borstvoeding tijdens het gebruik overwegen.[6]
Voorlichting aan de patiënt
Galcanezumab is bedoeld voor subcutane toediening in buik, dij, achterkant van de bovenarm of in het gluteale gebied. Een patiënt kan zichzelf injecteren door de gebruiksaanwijzing op te volgen. Een overgeslagen dosis dient men zo snel mogelijk te injecteren en dan verder te gaan met toediening eenmaal per maand. Binnen drie maanden na de start van de behandeling moet het nut van de behandeling worden beoordeeld.
Galcanezumab moet worden bewaard in de koelkast (2 tot 8 °C), niet in de vriezer, en in de oorspronkelijke verpakking ter bescherming tegen licht. Galcanezumab kan bij de patiënt buiten de koelkast tot zeven dagen worden bewaard bij temperaturen tot 30 °C. Bij overschrijding van deze omstandigheden moet de voorgevulde pen niet meer worden gebruikt en afgevoerd worden.[6]
Handelspreparaat, dosering en prijs
De firma Eli Lilly Nederland bv brengt galcanezumab onder de naam Emgality® op de markt.
Elke voorgevulde pen bevat 120 mg galcanezumab in 1 ml-oplossing, met als hulpstoffen L-histidine (hydrochloridemonohydraat), polysorbaat 80, natriumchloride en water voor injecties. De aanbevolen dosis is 120 mg galcanezumab, eenmaal per maand subcutaan geïnjecteerd, met 240 mg als eerste dosis. Het is geregistreerd voor de profylactische behandeling van migraine bij volwassenen die tenminste vier dagen per maand hieraan lijden.
Wanneer het preparaat voor de Nederlandse markt beschikbaar komt en wat de prijs wordt, is nog niet bekend, evenmin of het wordt opgenomen in het geneesmiddelenvergoedingssysteem (GVS).
Conclusie en plaatsbepaling
Galcanezumab is het tweede calcitonine-gen gerelateerd peptide (CGRP)-receptorantagonist monoklonaal antilichaam dat geregistreerd is voor profylaxe van migraine bij volwassenen die hier ten minste vier dagen per maand aan lijden. In de placebo-gecontroleerde studies bleek het ongeveer tweemaal zo effectief als placebo in de vermindering van het aantal migrainedagen per maand of in een reductie van meer dan de helft hiervan. Galcanezumab was ook effectief bij patiënten die eerder niet reageerden op eerdere profylaxebehandeling en bij patiënten met chronische migraine. Er is echter geen direct vergelijkend onderzoek bekend met de andere CGRP-receptorantagonist erenumab. Onderzoek naar de effectiviteit en de veiligheid op de lange termijn evenals direct vergelijkende studies zijn nodig om de definitieve plaats van galcanezumab te kunnen bepalen. Ook spelen de kosten en de vergoedingsstatus hierbij een rol. Vooralsnog lijkt galcanezumab daarom alleen een optie voor patiënten bij wie de huidige profylactische behandelmogelijkheden niet aanslaan of niet goed worden verdragen.
Literatuur
1. NHG-standaard Hoofdpijn. https://www.nhg.org/standaarden/samenvatting/hoofdpijn (geraadpleegd mei 2019).
2. Nederlandse Vereniging voor Neurologie. Medicamenteuze behandeling van migraine, medicatieovergebruikshoofdpijn en spanningshoofdpijn. https://richtlijnendatabase.nl/richtlijn/medicamenteuze_behandeling_migraine_en_moh/aanvalsbehandeling_migraine_met_triptanen.html (geraadpleegd mei 2019).
3. Scuteri D et al. New Trends in Migraine Pharmacology: Targeting Calcitonin Gene-Related Peptide (CGRP) With Monoclonal Antibodies. Front Pharmacol 09 April 2019.
4. Sacco S et al. European headache federation guideline on the use of monoclonal antibodies acting on the calcitonin gene related peptide or its receptor for migraine prevention. J Headache Pain 2019;20:6.
5. Heersche A, Bijlstra-Cramer MA. Erenumab; de eerste CGRP-antagonist bij migraine. Pharm Sel 2018;34:65-68.
6. SmPC Emgality®. www.ema.europa.eu (geraadpleegd mei 2019).
7. Stauffer VL et al. Evaluation of galcanezumab for the prevention of episodic migraine: The EVOLVE-1 randomized clinical trial. JAMA Neurol 2018;75:1080-1088.
8. Rosen N et al. 100% Response Rate to Galcanezumab in Patients With Episodic Migraine: A Post Hoc Analysis of the Results From Phase 3, Randomized, Double-Blind, Placebo-Controlled EVOLVE-1 and EVOLVE-2 Studies. Headache 2018;58:1347-1357.
9. Skljarevski V et al. Efficacy and safety of galcanezumab for the prevention of episodic migraine: Results of the EVOLVE-2 phase 3 randomized controlled clinical trial. Cephalalgia 2018;38:1442-1454. Published online May 31, 2018.
10. Detke HC et al. Galcanezumab in chronic migraine The randomized, double-blind, placebo-controlled REGAIN study. Neurology 2018;91:e2211-e2221.