Nr 18 Exenatide met verlengde afgifte, Bydureon® eenmaal per week, minstens zo werkzaam, iets minder Bywerking
Samenvatting
Met de komst van Bydureon® is een langwerkende formulering van exenatide op de markt gekomen die eenmaal per week kan worden toegediend. Klinische studies tonen aan dat de HbA1c-daling en nuchtere bloedglucosewaarden significant beter zijn ten opzichte van tweemaal daags exenatide en dat het effect op gewichtsverlies vergelijkbare resultaten laat zien. Ten opzichte van sitagliptine geeft exenatide op zowel HbA1c en nuchtere bloedglucosewaarden als op lichaamsgewicht een significante verbetering. In vergelijking met pioglitazon en insuline glargine is de verbetering significant voor HbA1c en gewichtsverlies - bij de laatste twee treedt gewichtstoename op. Bydureon® is een middel van keuze bij overgewicht en het verbeteren van therapietrouw. De veelvuldig optredende misselijkheid kan een bezwaar zijn, evenals de subcutane toediening. Op basis van de klinische resultaten en gebruiksgemak kan een voorkeur worden uitgesproken voor Bydureon® boven Byetta® (tweemaal daags exenatide).
M.K. Idskes en L.I. van de Ven, onder medeverantwoordelijkheid van de redactie
Pharma Selecta 2011 (november) nr 17
Abstract
Bydureon® is a long-acting formulation of exenatide that needs to be injected only once a week. Clinical studies have shown that the decrease in HbA1c and fasting blood glucose concentrations are significantly better with Bydureon®than with twice daily exenatide, and that the effect on weight loss was similar. Bydureon® significantly improved HbA1c, fasting blood glucose levels, and weight loss compared with sitagliptin, and significantly improved HbA1c and weight loss compared with pioglitazone and insulin glargine; the latter two drugs caused weight gain. Bydureon® is the drug of choice for overweight patients and for improving treatment compliance. Nausea, a common side effect, might be a problem and so too the subcutaneous route of administration. On the basis of clinical results and ease of use, Bydureon® is to be preferred to Byetta®(twice daily exenatide).
Pharm Sel 2011;27:99-103.
Inleiding
Diabetes mellitus type II (DM2) is wereldwijd een toenemend probleem. Ongeveer vijftien procent van de mensen van zeventig jaar en ouder lijdt aan deze aandoening. Tachtig tot negentig procent van hen heeft overgewicht.1 Door de toenemende prevalentie, variabele pathogenese (genetische en omgevingsfactoren), progressieve aard en complicaties is het noodzakelijk dat de behandelstrategieën worden uitgebreid.2
Glucagonachtige peptide 1 (GLP-1) is een incretinehormoon in de darm dat wordt afgegeven na een maaltijd. Het stimuleert insulineafgifte, remt glucagonafgifte, vertraagt maagdarmlediging en reduceert de eetlust en voedselinname. Het wordt snel geïnactiveerd door dipeptidyl peptidase-4 (DPP-4). De GLP-1-receptoragonisten (incretinemimetica) en DDP-4-remmers (incretineversterkers) intensiveren de werking van incretinehormonen. GLP-1-receptoragonisten zijn exenatide en liraglutide. DPP-4-remmers zijn sitagliptine, saxagliptine en vildagliptine.3
Byetta®, een formulering van exenatide die tweemaal daags wordt toegediend, leidt frequent tot maagdarmklachten. Het wordt op dit moment alleen vergoed voor DM2-patiënten met een BMI ‰¥35 kg/m2 die onvoldoende regulatie hebben met orale bloedglucose verlagende middelen. Een formulering met vertraagde afgifte van exenatide (Bydureon®) voor subcutane injectie eenmaal per week, is de eerste langwerkende formulering met een GLP-1-analoog die op de markt is gekomen. Deze formulering bevat exenatide, ingekapseld door microbolletjes van poly-DL-lactic-co-glycolide (poly-PLG). Het exenatide dat aan de oppervlakte zit zal in de eerste uren worden vrijgegeven (minder dan 1%), de rest diffundeert langzaam.2
In dit artikel wordt de wekelijkse formulering van exenatide vergeleken met de tweemaal daagse formulering en enkele andere behandelstrategieën bij diabetes mellitus type II.
Farmacologie
Dynamiek
Exenatide is een receptoragonist voor glucagonachtige peptide-1 die een aantal antihyperglykemische werkingen vertoont. De aminozuurvolgorde overlapt voor ongeveer 50% met humaan GLP-1. Daardoor is het werkingsmechanisme van exenatide vergelijkbaar met dat van GLP-1.3
In vitro is aangetoond dat exenatide de humane GLP-1-receptor activeert door cyclisch AMP (adenosinemonofosfaat) en/of andere intracellulaire routes. Het verhoogt de secretie van insuline door bètacellen op glucose-afhankelijke basis. Als de bloedglucosespiegel daalt, neemt de insulineafgifte af. Door dit glucose-afhankelijke insulinotrope mechanisme zou mogelijk ook geen toename in hypoglykemie worden gezien. Ook onderdrukt exenatide de glucagonafgifte - welke hoog is bij DM2 - wat leidt tot verminderde hepatische glucoseafgifte. Het vermindert niet de normale glucagonrespons en andere hormonale reacties op hypoglykemie. Exenatide vertraagt de maaglediging, waardoor de snelheid van glucoseopname na de maaltijden afneemt. Dankzij de afname van eetlust en een toegenomen verzadigingsgevoel, vermindert het tevens de voedselinname.4 Inmiddels blijkt tevens uit onderzoek dat na drie jaar behandeling met exenatide, de achteruitgang van de bètacellen afgeremd wordt.5
Kinetiek
Na de eerste toediening wordt na twee weken de minimaal werkzame plasmaconcentratie van ± 50 pg/ml bereikt, met een geleidelijke toename gedurende zes tot zeven weken tot een steady-state therapeutische concentratie van ongeveer 300 pg/ml.4 6 Het gemiddelde verdelingsvolume na een enkelvoudige dosis bedraagt 28 liter. Eliminatie vindt hoofdzakelijk plaats door glomerulaire filtratie met daaropvolgende proteolytische afbraak. De klaring bedraagt 9 l/uur. Ongeveer tien weken na stoppen van de behandeling, komen de gemiddelde exenatide plasmaconcentraties beneden de minimaal detecteerbare concentratie. Met deze periode moet rekening worden gehouden bij de keuze en dosering van andere geneesmiddelen, omdat de werking en bijwerkingen tien weken na staken nog kunnen voortduren. Bij een lichte nierfunctiestoornis (creatinineklaring 50-80 ml/min) is geen dosisaanpassing nodig. Klinische ervaring bij een matige nierfunctiestoornis (creatinineklaring 30-50 ml/min) is beperkt en wordt niet aanbevolen. Het gebruik wordt afgeraden bij patiënten met een terminale nierziekte of ernstige nierinsufficiëntie (creatinineklaring <30 ml/min). Bij patiënten met leverfunctiestoornissen is geen dosisaanpassing nodig, omdat exenatide voornamelijk via de nieren geklaard wordt.4
Klinische studies
De klinische Duration-studies bestaan uit 24 tot 30 weken durende studies die de veiligheid en effectiviteit vergeleken van exenatide eenmaal per week versus exenatide tweemaal per dag (Duration-1 en -5) versus maximum dagdoseringen van sitagliptine of pioglitazon in combinatie met metformine (Duration-2) en versus insuline glargine (Duration-3).7-10 De studies zijn gesponsord door Amylin Pharmaceuticals en Eli Lilly. Het primaire eindpunt in alle studies was de verandering in HbA1c-waarde. Secundaire eindpunten waren onder andere verandering van lichaamsgewicht en nuchtere bloedglucosewaarden. Patiënten waren ‰¥16€‰-€‰18 jaar en werden al tenminste twee maanden voor screening niet-medicamenteus of medicamenteus behandeld (Duration-1 en -5), met metformine (Duration-2) of met metformine of met de combinatie metformine en een sulfonylureumderivaat (Duration-3). Verdere inclusiecriteria waren onder andere een HbA1c-waarde van 7,1-11,0%, nuchter plasmaglucose <16 mmol/L en BMI 25-45 kg/m2.
In Duration-1 - gerandomiseerd, open-label, non-inferiority, n=295 (intention-to-treat) - kregen alle patiënten een oplaaddosis van 5 mcg exenatide tweemaal per dag gedurende drie dagen. Vervolgens werden de patiënten verdeeld over twee groepen. De ene groep kreeg exenatide 2,0 mg per week, de andere groep kreeg 5 mcg tweemaal per dag gedurende 28 dagen en daarna 10 mcg tweemaal per dag. HbA1c werd bepaald in week 0, 6, 10, 14, 18, 22, 26 en 30.7
In Duration-5 - gerandomiseerd, open-label, n=252 - kregen patiënten exenatide 2,0 mg/week of 5 mcg tweemaal per dag gedurende vier weken, gevolgd door 10 mcg tweemaal per dag. HbA1c werd bepaald in week 0, 4, 8, 14, 20 en 24.8
In Duration-2 - gerandomiseerd, dubbelblind, n=491 - kregen patiënten exenatide 2 mg per week en oraal placebo eenmaal per dag; sitagliptine 100 mg per dag en placebo-injectie eenmaal per week of pioglitazon 45 mg per dag en placebo-injectie eenmaal per week. HbA1c werd bepaald in week 0, 4, 6, 10, 14, 18, 22 en 26.9
In Duration-3 - gerandomiseerd, open-label, n=456 - kregen patiënten exenatide 2 mg per week of insuline glargine eenmaal daags met startdosering van 10E en bijstellen ervan tot een glucosespiegel van 4,0€‰-€‰5,5 mmol/L. HbA1cwerd bepaald in week 0, 8, 14, 18, 22 en 26.10
Alle behandelingen in de Duration-studies gaven een verbetering in glykemische controle. Exenatide 2 mg per week gaf een HbA1c-afname tussen de 1,5 en 1,9% - significant beter dan alle andere behandelingen (Duration-1: p=0,0023 bij exenatide tweemaal per dag; Duration-5: p<0,0001 bij exenatide tweemaal per dag; Duration-2: p<0,0001 bij sitagliptine, p=0,0165 bij pioglitazon; Duration-3: p=0,017 bij insuline glargine). Van alle patiënten behandeld met exenatide eenmaal per week bereikten 58-71% een HbA1c-streefwaarde <7% (<53 mmol/mol), significant meer dan de andere behandelingen (p<0,05). De afname van nuchtere bloedglucosewaarden was significant verschillend ten opzichte van exenatide tweemaal per dag (Duration-1: p<0,0001; -Duration-5: p=0,0008) en ten opzichte van sitagliptine (p<0,0001) en was vergelijkbaar met de afname bij pioglitazongebruik (p=0,0102). Insuline glargine gaf een grotere afname in bloedglucosewaarden (p=0,001).
Gewichtsverlies bij exenatide eenmaal per week was consistent in alle Duration-studies van 2 tot 4 kg en gelijk aan tweemaal daagse toediening (p>0,05). Gewichtsverlies bij exenatide eenmaal per week was significant groter dan bij sitagliptine (p=0,0002), pioglitazon (p<0,0001) en insuline glargine (p<0,0001). Bij deze laatste twee trad een gewichtstoename op (bij pioglitazon gemiddeld 2,8 kg, bij insuline glargine 1,4 kg). Over het algemeen had 70-79% van de patiënten met exenatide eenmaal per week een afname in HbA1c en gewichtsverlies vergeleken met 51-74% bij exenatide tweemaal per dag, 46% bij sitagliptine, 14% bij pioglitazon en 31% bij insuline glargine.
Uitval wegens bijwerkingen was consistent tussen de studies (Duration-1: 6% bij exenatide met verlengde afgifte, 5% bij gewoon exenatide; Duration-5: beide exenatideformuleringen 5%; Duration-2: 7% bij exenatide met verlengde afgifte, 3% bij sitagliptine, 4% bij pioglitazon; Duration-3: 5% bij exenatide met verlengde afgifte, 1% bij insuline glargine). Bij beide exenatideformuleringen werd deze uitval hoofdzakelijk veroorzaakt door gastro-intestinale bijwerkingen.
Bijwerkingen
Hier worden alleen de zeer vaak (‰¥1/10) voorkomende bijwerkingen genoemd. De meest gemelde bijwerking was misselijkheid (range in Duration-studies van 13-26%). Dit kwam minder vaak voor bij toediening eenmaal per week dan bij tweemaal per dag (9% minder in Duration-1, 21% minder dan in Duration-5). Mogelijk wordt dit veroorzaakt doordat de steady-state concentratie langzaam wordt bereikt.5 De meeste episoden waren licht tot matig van aard en de frequentie nam af bij voortzetting van de behandeling. Ook andere maagdarmklachten als obstipatie, diarree en braken werden vaak gemeld.4
Een andere zeer vaak gemelde bijwerking was een huidreactie (pruritis, urticaria, rash, erytheem) op de injectieplaats (range in Duration-studies van 5-18%). Deze waren vaak licht van aard en leidden doorgaans niet tot terugtrekking uit de studies. Er werden - in overeenstemming met preparaten met een formulering met vertraagde afgifte - frequent kleine subcutane knobbeltjes op de injectieplaats waargenomen, welke na vier tot acht weken verdwenen. Bij tweemaal daagse toediening werd dit minder gezien (Duration-1: 1%; Duration-2: 10%).
De incidentie van hypoglykemie was verhoogd als exenatide samen werd gebruikt met een sulfonylureumderivaat (Duration-1: 15%; Duration-5: 12% versus Duration-1: <1%; Duration-5: 0% bij geen gelijktijdig gebruik). Deze incidentie was bij de tweemaal daagse toediening vergelijkbaar. Om dit risico - geassocieerd met gelijktijdig gebruik van een sulfonylureumderivaat - te reduceren, kan verlaging van de dosering van het sulfonylureumderivaat in overweging worden genomen. De incidentie van hypoglykemie was significant lager dan bij insuline glargine bij patiënten die ook metformine kregen (3 versus 19%, p<0,0001) en bij metformine en sulfonylureumderivaat (20 versus 42%, p=-0,009). In de meeste gevallen verdween deze na toediening van koolhydraten.
Geneesmiddelen op basis van eiwitten en peptiden hebben potentieel immunogene eigenschappen, waardoor antilichamen tegen exenatide ontwikkeld kunnen worden. De antilichaamtiters daalden bij de meeste patiënten na verloop van tijd.7 De aanwezigheid van antilichamen (hoge of lage titers) had geen voorspellende waarde voor de afname in -HbA1c.7-10
Interacties
De resultaten van een studie die paracetamol gebruikte als marker van maaglediging, wijst erop dat het effect van eenmaal per week exenatide op het vertragen van de maaglediging gering is en naar verwachting geen klinisch significante reductie geeft in de snelheid en omvang van absorptie van gelijktijdig toegediende orale geneesmiddelen. Er is daarmee geen dosisaanpassing nodig voor geneesmiddelen die gevoelig zijn voor een vertraagde maaglediging. Dit in tegenstelling tot tweemaal daags exenatide waarbij dat wel geadviseerd wordt.10 De dosering van sulfonylureumderivaten moet mogelijk worden aangepast vanwege de verhoogde kans op hypoglykemie, gerelateerd aan behandeling met sulfonylureumderivaten. Daarnaast zijn er interacties beschreven gebaseerd op 10 mcg exenatide tweemaal daags, maar niet met exenatide eenmaal per week. De AUC en Cmax van hydroxymethylglutarylco-enzym-A(HMG-CoA)-reductaseremmers kan worden verlaagd. Hoewel er geen vooraf vastgestelde aanpassing van dosis nodig is, dienen de lipideprofielen op een geschikte wijze gecontroleerd te worden. Indien patiënten behandeld worden met cumarinederivaten dient de INR gecontroleerd te worden bij aanvang van de behandeling vanwege een mogelijke verhoging bij gelijktijdig gebruik. Gelijktijdig gebruik met insuline, meglitiniden, dipeptidylpeptidase-4-remmers (DDP4-remmers), alfaglucosidaseremmers of andere GLP-1-receptoragonisten is niet onderzocht.4
Contra-indicaties
Overgevoeligheid voor het werkzame bestanddeel of een van de hulpstoffen. Patiënten met DM1 of diabetische keto-acidose mogen exenatide met verlengde afgifte niet gebruiken. Doordat exenatide in deze formulering de maaglediging kan vertragen en maagdarmklachten kan geven, wordt het gebruik niet aanbevolen bij patiënten met een ernstige gastro-intestinale ziekte. Snel gewichtsverlies (>1,5 kg/week) is gerapporteerd. Dit kan consequenties hebben voor het gebruik. Omdat er onvoldoende ervaring is met het gebruik bij kinderen en adolescenten jonger dan achttien jaar, wordt exenatide met verlengde afgifte niet aanbevolen in deze leeftijdsgroep. Ook dient het niet gebruikt te worden door patiënten met matige tot ernstige nierfunctiestoornissen.4
Bijzondere voorzorgen
Indien van gewoon exenatide wordt omgeschakeld op exenatide met verlengde afgifte kunnen voorbijgaande verhogingen in bloedglucosewaarden optreden; deze verbeteren gewoonlijk binnen de eerste twee weken na aanvang van de therapie.
Als exenatide met verlengde afgifte wordt toegevoegd aan metformine en/of een thiazolidinedion, kan de bestaande dosering van deze middelen worden voortgezet. Als het wordt toegevoegd aan behandeling met een sulfonylureumderivaat, moet een verlaging van de dosis sulfonylureumderivaat worden overwogen om het risico van hypoglykemie te verlagen.4
Kinderwens, zwangerschap en borstvoeding
Er zijn geen toereikende gegevens beschikbaar over gebruik van exenatide met verlengde afgifte bij zwangere vrouwen. Uit onderzoek is reproductietoxiciteit gebleken. Om deze redenen mag dit middel niet tijdens de zwangerschap gebruikt worden. Gebruik van insuline wordt aanbevolen. Daarom moeten vrouwen in de vruchtbare leeftijd gedurende de behandeling anticonceptie toepassen. Het gebruik dient - vanwege de lange eliminatietijd - ten minste drie maanden vóór een geplande zwangerschap gestaakt te worden. Het is niet bekend of exenatide in de moedermelk wordt uitgescheiden. Om deze reden wordt gebruik afgeraden in de periode waarin borstvoeding wordt gegeven.4
Voorlichting aan de patiënt
Exenatide met verlengde afgifte moet wekelijks op dezelfde dag worden toegediend. Het kan op elk moment van de dag, met of zonder een maaltijd. De dag kan, indien nodig, worden gewijzigd zolang de volgende dosis tenminste 24 uur later wordt toegediend. Een dosis moet direct na suspenderen van het poeder in het oplosmiddel in de buik, dij of achterkant van de bovenarm worden toegediend als subcutane injectie - niet intraveneus of intramusculair. Als elke week hetzelfde gebied wordt gekozen, moet steeds op een andere plaats worden geïnjecteerd. Indien een dosis wordt gemist, kan deze worden toegediend zodra dit wordt gemerkt. De volgende injectie kan dan weer op de gekozen dag, maar tenminste 24 uur later worden gegeven.
Het product dient bewaard te worden in de koelkast (2 °C - 8 °C), niet in de vriezer. Voorafgaand aan het gebruik mag de kit tot vier weken beneden 30 °C bewaard worden. Elke kit met één dosis bevat een injectieflacon met 2 mg exenatide, een voorgevulde spuit met 0,65 ml oplosmiddel, een koppelstuk voor de injectieflacon en twee injectienaalden, waarvan één reserve. Het oplosmiddel moet voor gebruik visueel onderzocht worden op helderheid en op afwezigheid van deeltjes. Na suspenderen mag het product alleen gebruikt worden als het mengsel wit tot gebroken wit en troebel is. Exenatide met verlengde afgifte moet onmiddellijk na suspenderen worden geïnjecteerd.4 12
Handelspreparaat, dosering en prijs
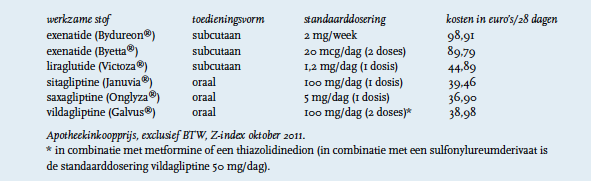
Exenatidepoeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte is op de markt gebracht door Eli Lilly onder de naam Bydureon®. Het is geïndiceerd voor de behandeling van diabetes mellitus type II in combinatie met metformine, sulfonylureumderivaten, een thiazolidinedion, metformine en een sulfonylureumderivaat of metformine en een thiazolidinedion bij volwassenen waarbij geen adequate glykemische controle wordt bereikt bij maximaal verdraagbare doseringen van deze orale middelen.4 De aanbevolen dosering is 2 mg exenatide eenmaal per week per subcutane injectie.
Om voor vergoeding in aanmerking te komen moet het eerste recept worden uitgeschreven door een internist. Er moet sprake zijn van fors overgewicht (BMI ‰¥35 kg/m2) en de bloedglucosewaarden moeten onvoldoende kunnen worden gereguleerd met de combinatie van metformine en een sulfonylureumderivaat in de maximaal verdraagbare doseringen. Tevens mag geen insuline worden gebruikt, tenzij de verzekerde al op 1 mei 2011 met dit middel in combinatie met insuline werd behandeld. De artsenverklaring en apotheekinstructie zijn te vinden op www.znformulieren.nl.
Conclusie en plaatsbepaling
Met de komst van Bydureon® is een langwerkende formulering van exenatide ontwikkeld die eenmaal per week kan worden toegediend. Door deze subcutane formulering wordt een constante afgifte bewerkstelligd.
De klinische studies hebben aangetoond dat exenatide eenmaal per week, net als exenatide tweemaal per dag - toegevoegd aan een bestaande behandeling - een daling geeft in HbA1c, een verbetering van nuchtere bloedglucosewaarden en een reductie van het lichaamsgewicht. De daling in HbA1c en verbetering van nuchtere bloedglucosewaarden waren significant ten opzichte van tweemaal daags exenatide; het gewichtsverlies was vergelijkbaar. Ten opzichte van sitagliptine gaf exenatide op zowel HbA1c en nuchtere bloedglucosewaarden als lichaamsgewicht een significante verbetering. Bij pioglitazon en insuline glargine was het verschil significant voor HbA1cen gewichtsverlies, waarbij gewichtstoename optrad bij pioglitazon en insuline glargine. Gewichtstoename leidt tot verergering van al aanwezige risicofactoren op hart- en vaatziekten, zoals ongevoeligheid voor insuline, verhoogd cholesterol en verhoogde bloeddruk. De gewichtsvermindering die exenatide geeft door het remmen van de maaglediging, met als gevolg een versterkt verzadigingsgevoel, is hierbij een voordeel. Misselijkheid is een vaak voorkomende bijwerking bij beide exenatideformuleringen, maar werd bij wekelijkse toediening minder gezien. Reacties op de injectieplaats kwamen bij de wekelijkse toediening echter vaker voor, wat inherent zou zijn aan de formulering.
Exenatide met verlengde afgifte is een middel van keuze bij overgewicht en het verbeteren van therapietrouw. De veelvuldig optredende misselijkheid kan een bezwaar zijn, evenals de subcutane toediening. Op basis van de klinische resultaten en gebruiksgemak kan een voorkeur voor Bydureon® boven Byetta® worden uitgesproken.
Exenatide wordt slechts bij ernstig overgewicht en na falen van orale therapie vergoed. Inmiddels is er enkele jaren ervaring met exenatide, waardoor bekend is dat de achteruitgang van de bètacel wordt afgeremd en het eveneens gewichtsafname bewerkstelligt. Er is nu dus een wekelijkse injectie beschikbaar. De vraag rijst of niet een grotere groep patiënten gebruik zou moeten kunnen maken van dit middel in deze formulering.
Literatuur
1 Merck Manual - Medisch handboek. Pag. 970. Bohn Stafleu van Loghum, Houten 2003.
2 Tahrani AA et al. Management of type 2 diabetes: new and future developments in treatment. Lancet 2011;378:182-197.
3 Drucker DJ, Nauck M. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. Lancet 2006;368:1696-1705.
4 1B-tekst Bydureon®. www.cbg-meb.nl. Geraadpleegd september 2011.
5 Veel voordelen aan wekelijkse diabetesbehandeling. Pharm Weekblad 2011;38:21.
6 DeYoung MB et al. Encapsulation of exenatide in poly-(D,L-lactide-co-glycolide) microspheres produced an investigational long-acting once-weekly formulation for type 2 diabetes. Diabetes Technol The 2011;13(11):1-7.
7 Drucker DJ et al. Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomised, open-label, non-inferiority study (Duration-1). Lancet 2008;372:1240-1250.
8 Blevins T et al. Duration-5: Exenatide once weekly resulted in greater improvements in glycemic control compared with exenatide twice daily in patients with type 2 diabetes. J Clin Endocrinol Metab 2011;96(5):1301-1310.
9 Bergenstal RM et al. Efficacy and safety of exenatide once weekly versus sitagliptin or pioglitazone as a adjunct to metformin for treatment of type 2 diabetes (Duration-2): a randomised trial. Lancet 2010;376:431-439.
10 Diamant M et al. Once weekly exenatide compared with insulin glargine titrated to target in patients with type 2 diabetes (Duration-3): an open label randomised trial. Lancet 2010;375:2234-2243.
11 1B-tekst Byetta®. www.cbg-meb.nl. Geraadpleegd oktober 2011.
12 Bijsluiter Bydureon®. www.cbg-meb.nl. Geraadpleegd oktober 2011.
- Gegevens
- Hoofdcategorie: Hoofdartikel
- Categorie: 2011