Samenvatting
Pegloticase (Krystexxa®) is een langwerkende vorm van het eerder gelanceerde rasburicase (Fasturtec®). Pegloticase is ontwikkeld voor patiënten met chronische jicht, waarbij langdurige behandeling met allopurinol of febuxostat onvoldoende effect heeft. Klinische studies tonen aan dat bij veertig procent van de patiënten een reductie van het aantal tofi optreedt en dat de concentratie van urinezuur daalt tot een gewenst niveau. Omdat pegloticase een lichaamsvreemd eiwit is dat via intraveneuze infusie moet worden toegediend, krijgt een groot deel van de patiënten last van infusie-gerelateerde reacties, hierbij is de mogelijkheid van een anafylactische shock aanwezig. Daarnaast neemt de frequentie van de jichtaanvallen toe tijdens de eerste drie maanden van de behandeling, zodat profylaxe met allopurinol en colchicine noodzakelijk is gedurende het hele behandeltraject. Pegloticase is geen wondermiddel, maar meer een laatste, moeilijk verdraagbare optie tot een beter alternatief beschikbaar is.
Pharma Selecta 2013 (mei) nr 7
Abstract
Pegloticase (Krystexxa®) is a long-acting formulation of the previously introduced rasburicase (Fasturtec®). It was developed for patients with chronic gout refractory to long-term treatment with allopurinol or febuxostat. Clinical studies have shown that it reduces the number of tophi in 40% of patients and lowers the concentration of uric acid to target levels. Because pegloticase is a foreign protein that is administered by intravenous infusion, many patients experience infusion-related reactions; anaphylactic shock can occur. In addition, gout flares are more common during the first three months of treatment, necessitating prophylaxis with allopurinol and colchicine throughout treatment. Pegloticase is not a wonder drug, but is possibly the latest, poorly tolerable option until a better alternative becomes available.
Pharm Sel 2013;29:29-31.
Inleiding
Jicht is een naam voor verschillende aandoeningen die alle worden gekenmerkt door de vorming en neerslag van naaldvormige natriumuraatkristallen. Dit is het gevolg van afwijkingen van de purine- en urinezuurstofwisseling die zorgen voor het ontstaan van een te hoge plasmaconcentratie van urinezuur. Dit leidt tot het neerslaan van naaldvormige uraatkristallen in het synoviale vocht (gewrichtsvloeistof), in onderhuids bindweefsel, gewrichten en in andere structuren die kraakbeen bevatten. Door fagocytering van de kristallen ontstaat een acute en hevige ontstekingsreactie waarbij roodheid, zwelling en pijn rondom het gewricht (tofi) op de voorgrond staan. Deze heftige en pijnlijke reactie wordt een jichtaanval genoemd.
Jicht kan worden geschaard onder de welvaartsziekten. Risicofactoren voor het ontwikkelen van jicht zijn: familiaire predispositie, geslacht (de prevalentie van jicht is tienmaal hoger bij mannen dan bij vrouwen), voedings- en drinkgewoonten (alcohol en veel vlees), overgewicht, verminderde nierfunctie, trauma en stress.
Urinezuur is een afbraakproduct van adenine en guanine – bestanddelen van DNA. Adenine en guanine worden omgezet in xanthine, wat vervolgens door xanthine-oxidase wordt omgezet in urinezuur. Tweederde van de totale dagelijkse hoeveelheid urinezuur wordt via de urine uitgescheiden. De rest wordt uitgescheiden via de tractus digestivus.
De behandeling van jichtaanvallen bestaat meestal uit (een combinatie van) NSAID’s en/of colchicine. Patiënten met meer dan drie jichtaanvallen per jaar hebben een chronische vorm van jicht en komen in aanmerking voor levenslange urinezuurverlagende therapie in de vorm van allopurinol (een xanthine-oxidaseremmer). Indien toepassing van allopurinol niet gewenst is, kan worden overgestapt op benzbromaron. Redenen voor het niet toepassen van allopurinol zijn bijvoorbeeld een lage nierfunctie of het uitblijven van effect. Niet alle patiënten bereiken echter een reductie van jichtaanvallen door het gebruik van allopurinol en/of benzbromaron.1 3
Het enzym uraatoxidase (uricase) zet urinezuur om in allantoïne, dat goed oplosbaar is in water en snel renaal geklaard kan worden (figuur 1).4 Rasburicase (Fasturtec®) was de eerste recombinante vorm van uricase die werd ingezet bij de behandeling en profylaxe van acute hyperuricemie om acuut nierfalen te voorkomen bij volwassenen. Rasburicase heeft echter een aantal nadelen: het heeft een zeer korte halfwaardetijd, het mag maar zeven dagen gebruikt worden, het moet als kortlopend infuus (dertig minuten) worden toegediend en het roept vaak ernstige allergische reacties op. Pegloticase (Krystexxa®) is een recombinante vorm van uricase die covalent gebonden is aan monomethoxy-PEG, waardoor de halfwaardetijd langer is in vergelijking met rasburicase.
Op 8 januari 2013 werd pegloticase (Krystexxa®) door de European Medicines Agency (EMA) goedgekeurd voor de behandeling van chronische jicht die niet goed reageert op conventionele urinezuurverlagende therapie. In dit artikel geven we een plaatsbepaling van pegloticase.
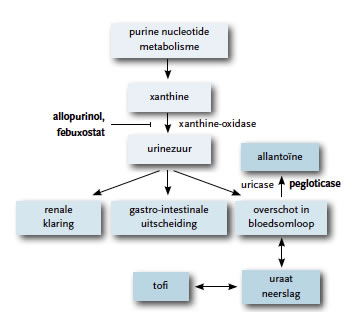
Figuur 1 Aangrijpingspunten van allopurinol en pegloticase.4
Farmacologie
Dynamiek
Pegloticase is een recombinante vorm van het enzym uricase dat de oxidatie van urinezuur naar allantoïne katalyseert. Als oxidatieve bijproducten van deze omzetting ontstaan waterstofperoxide en kooldioxide. Allantoïne is in water oplosbaar en wordt door middel van glomerulaire filtratie goed uit het lichaam verwijderd. De serumspiegel van urinezuur neemt hierdoor af, wat leidt tot een concentratie-gradiënt tussen het urinezuur in het serum en de naaldvormige mononatriumuraatneerslagen in de gewrichtsvloeistof. Daardoor migreert het urinezuur uit de weefsels/gewrichten en kan het worden omgezet in allantoïne.5
Kinetiek
Na intraveneuze toediening bereikt pegloticase een maximale plasmaconcentratie na 2,25 uur. De t1/2 van pegloticase is 214 uur. Eliminatie van het middel vindt voornamelijk plaats door urinaire excretie. Er zijn nog geen studies gedaan naar het gebruik van pegloticase bij patiënten met een verminderde nierfunctie.5
Klinisch onderzoek
Gout-I
In een gerandomiseerd, dubbelblind, placebo-gecontroleerd fase 3-onderzoek is pegloticase vergeleken met placebo. Er werden 104 patiënten gerandomiseerd naar drie behandelgroepen in de verhouding 2:2:1. Patiënten werden gedurende zes maanden behandeld met 8 mg pegloticase per twee weken (n=43), 8 mg pegloticase per vier weken (n=41) of placebo (n=20). Het primaire eindpunt van de studie werd gedefinieerd als het percentage patiënten dat in serum een urinezuurconcentratie van <0,36 mmol/L had gedurende 80% van de tijd in maand 3 en 6. Patiënten met in de afgelopen achttien maanden ≥3 aanvallen van jicht, ≥1 tofus en een urinezuurconcentratie in serum van ≥8,0 mg/dL ondanks behandeling met de maximaal acceptabele dosis allopurinol, werden geëxcludeerd. Het primaire eindpunt werd gehaald door 46,5% (p<0,001), 19,5% (p<0,044) en 0% van de patiënten in respectievelijk de groep met pegloticase 8 mg per twee weken, de groep met pegloticase 8 mg per vier weken en de placebogroep. Als secundair eindpunt werd onder andere gekeken naar de grootte van en het aantal aanwezige tofi en het aantal opvlammingen van jicht. Bij respectievelijk 40,4, 21,2 en 6,9% van de patiënten waren één of meer tofi volledig verdwenen. Het aantal aanvallen van jicht was hoger in zowel de groep met pegloticase 8 mg per twee weken (77%), als de groep met pegloticase 8 mg per vier weken (81%) versus de placebogroep (54%) (p<0,007). Het percentage opvlammingen van jicht was lager in beide pegloticasegroepen dan in de placebogroep na een behandelperiode van vier maanden: voor pegloticase 8 mg per twee weken was dit 41%, voor pegloticase 8 mg per vier weken 57% en voor placebo 67% (p<0,007). Na een behandelperiode van zes maanden waren ≥1 tofus bij respectievelijk 40,4, 21,2 en 6,9% van de patiënten verdwenen.6 7
Gout-II
In een gerandomiseerd, dubbelblind, placebo-gecontroleerd, zes maanden durend fase 3-onderzoek is pegloticase vergeleken met placebo. Er werden 108 patiënten gerandomiseerd naar drie behandelgroepen in verhouding 2:2:1. Patiënten werden behandeld met 8 mg pegloticase per twee weken (n=42), 8 mg pegloticase per vier weken (n=43) of placebo (n=23). Het primaire eindpunt van de studie werd gedefinieerd als het percentage patiënten dat een uraatconcentratie <0,36 mmol/L had gedurende 80% van de tijd in maand 3 en 6. Patiënten met in de afgelopen achttien maanden ≥3 aanvallen van jicht, ≥1 tofus en een urinezuurconcentratie in serum van ≥8,0 mg/dL ondanks behandeling met de maximaal acceptabele dosis allopurinol, werden geëxcludeerd. Het primaire eindpunt werd gehaald door 38,1% (p<0,001), 48,8% (p<0,001) en 0% van de patiënten in respectievelijk de groep met pegloticase 8 mg per twee weken, de groep met pegloticase 8 mg per vier weken en de placebogroep.6 7
Bijwerkingen
Bijwerkingen die tijdens de fase 3-studies het meest werden gerapporteerd zijn anafylaxie (6,5%) en infusiereacties, zoals het plotseling ontstaan van erytheem, jeuk, huiduitslag, flushing, koude rillingen en hypertensie (26%). Ook werden vaak aanvallen van jicht gemeld. Deze kwamen tijdens de eerste drie maanden van behandeling vaker voor (77%). Daarnaast kwam bij 1-10% van de patiënten hyperglykemie en braken voor. Meer dan 10% van de patiënten gaf aan misselijk te worden tijdens de behandeling. Bij patiënten met een gewicht van >100 kg kwamen vaker infusiegerelateerde reacties voor dan bij patiënten met een lager gewicht.5
Interacties
Er is geen onderzoek naar interacties met andere geneesmiddelen uitgevoerd. Anti-pegloticase-antistoffen kunnen aan het PEG-deel van pegloticase binden. Daarom kunnen ze potentieel ook aan andere gePEGyleerde middelen binden.5 Geadviseerd wordt om voorafgaand aan behandeling met pegloticase orale uraatverlagende geneesmiddelen te staken. Ook wordt aangeraden tijdens behandeling met pegloticase geen orale uraatverlagende geneesmiddelen toe te passen. Gelijktijdig gebruik van deze geneesmiddelen kan namelijk mogelijk de toename van het serumurinezuur maskeren. Deze toename wordt geassocieerd met responsverlies. Patiënten die naast pegloticase orale uraatverlagende geneesmiddelen gebruiken, kunnen een verhoogd risico hebben op anafylaxie en/of infusiereacties.5
Contra-indicaties
Pegloticase is gecontraïndiceerd bij patiënten met een bekende G6PD-deficiëntie, vanwege een verhoogd risico op het ontwikkelen van hemolyse of methemoglobinemie. Bij patiënten bij wie de serumurinezuurspiegel bij twee opeenvolgende bepalingen >6 mg/dl (360 micromol/l) is, mag pegloticase niet worden toegepast.5
Zwangerschap en lactatie
Omdat er nog geen gegevens zijn over het gebruik van pegloticase bij zwangere vrouwen, wordt het aangeraden om dit middel niet te gebruiken tijdens de zwangerschap. Tevens is het nog niet bekend of pegloticase of een van de metabolieten in de moedermelk wordt uitgescheiden. Vooralsnog wordt aangeraden om tijdens het gebruik van dit middel geen borstvoeding te geven.5
Voorlichting aan de patiënt
Aan het begin van de behandeling met pegloticase moet men erop bedacht zijn dat de kans op het ontwikkelen van een jichtaanval vergroot is. Ter profylaxe wordt colchicine of een NSAID voorgeschreven om aanvallen van jicht te voorkomen. Deze preventieve behandeling wordt een week voor behandeling gestart en gecontinueerd gedurende de behandelperiode van zes maanden. Behandeling met pegloticase kan ernstige allergische reacties induceren. Het is raadzaam om patiënten voorafgaand aan een behandeling, voor te behandelen met antihistaminica, corticosteroïden en paracetamol. Bij het optreden van een infusiegerelateerde reactie, kan het zijn dat de arts de infusiesnelheid van het preparaat vertraagt of tijdelijk stopzet.5
Handelspreparaat, dosering en prijs
Pegloticase wordt als concentraat voor infusie (8 mg/ml) op de markt gebracht onder de naam Krystexxa® door Savient Pharma. De aanbevolen dosis van is 8 mg, elke twee weken toegediend als een intraveneuze infusie. Een ampul met 1 ml Krystexxa® wordt verdund met 250 ml NaCl 0,45 of 0,9%. De oplossing wordt via een intraveneus infuus toegediend gedurende minimaal twee uur met een inloopsnelheid van ongeveer 2 ml per uur. De prijs van Krystexxa® is nog niet bekend.
Conclusie en plaatsbepaling
Pegloticase is geregistreerd voor behandeling van patiënten met chronische jicht, waarbij langdurige behandeling met xanthineoxidaseremmers (allopurinol of febuxostat) de ziekte onvoldoende onder controle weet te houden. Pegloticase is een recombinante vorm van uricase, een lichaamsvreemd enzym dat in staat is om urinezuur om te zetten in het in goed water oplosbare allantoïne.3 Omdat pegloticase een lichaamsvreemd eiwit is, stimuleert toediening het aanmaken van antilichamen tegen pegloticase, wat resulteert in een relatief grote groep non-responders (circa 58%). Patiënten die wel reageren op de therapie (circa 40%) ervaren een vermindering van het aantal tofi en lijken er baat bij te hebben gedurende de zes maanden dat ze behandeld worden. Zowel responders als non-responders hebben echter last van bijwerkingen die ontstaan door de immunologische respons van het lichaam op het middel, zoals infusiegerelateerde reacties en anafylaxie. Daarnaast neemt tijdens de eerste drie maanden van de behandeling de frequentie van het aantal aanvallen van jicht toe, waardoor patiënten profylactisch moeten worden behandeld met allopurinol/febuxostat en colchicine. Pegloticase is daarom geen wondermiddel, maar meer een laatste, moeilijk verdraagbare optie tot er een beter alternatief beschikbaar is.
Literatuur
1http://www.nhg.org/standaarden/samenvatting/arttritis
3Stehouwer CDA, Koopmans RP, Van der Meer J. Reumatische ziekten; paragraaf 22.9.1 Kristalartritis, in: Interne Geneeskunde, 14e herziene druk, 2010, p. 931-933.
4Burns CM, Wortmann RL. Gout therapeutics: new drugs for an old disease. Lancet 2011;377:165-177.
5Krystexxa®, Summary of Product Characteristics.
6Sundy JS, Baraf HS, Becker MA et al. Efficacy and safety of intravenous (IV) pegloticase (PGL) in subjects with treatment failure gout (TGF): phase 3 results from GOUT1 and GOUT2. Arthritis Rheum 2008;58 Suppl 9:S635.
7Sundy JS, Baraf HS, Becker MA et al. Efficacy and safety of intravenous (IV) pegloticase (PGL) in subjects with treatment failure gout (TGF): phase 3 results from GOUT1 and GOUT2. Ann Rheum Dis 2009;68 Suppl 3:S318.