Samenvatting
Pseudobulbair affect (PBA) is een aandoening waarbij, door schade aan de hersenen, spontane lach- en huilbuien kunnen ontstaan. Tot op heden was er voor behandeling van deze aandoening geen middel geregistreerd. Met de registratie van een combinatiepreparaat met dextromethorfan en kinidine (Nuedexta®) is hier verandering in gekomen. De kinidine zorgt voor een verhoogde beschikbaarheid van dextromethorfan. Bij het gebruik van deze combinatie hebben de patiënten een duidelijke afname van het aantal aanvallen per dag en een lagere CNS-LS die de ernst van PBA aangeeft. Nadelen zijn de vrij uitgebreide interacties, vooral met betrekking tot CYP-enzymen. Daarnaast zijn er verschillende contra-indicaties, waaronder de invloed op het QT-interval.
M.A. Cramer en J.F.J. Lüers, onder medeverantwoordelijkheid van de redactie
Pharma Selecta 2013 (oktober) nr 11
Abstract
Pseudobulbar affect (PBA) is a disorder whereby brain damage leads to involuntary episodes of crying or laughing. Until the dextromethorphan/quinidine combination drug (Nuedexta®) was approved, there was no approved treatment for this condition. Quinidine increases the availability of dextromethorphan. Use of the combination medicine decreases the number of daily episodes of laughing/crying and reduces PBA severity, as measured with the CNS-LS. A disadvantage is the interaction with other drugs, and especially those metabolized through the CYP enzyme system. There are also a number of contraindications, such as its effect on the QT-interval.
Pharm Sel 2013;29:65-68.
Inleiding
Pseudobulbair affect (PBA) is een aandoening waarbij, door schade aan de hersenen, lach- of huilbuien kunnen optreden.1 Deze episodes kunnen soms een buitenproportionele reactie op een gebeurtenis zijn, maar het hoeft niets met de emotionele staat van de patiënt te maken te hebben. De persoon in kwestie heeft geen controle over de episodes. Verschillende aandoeningen kunnen ten grondslag liggen aan het optreden van PBA, waaronder multiple sclerose (MS), amyotrofische laterale sclerose (ALS), cerebrovasculair accident (CVA) en de ziekte van Alzheimer. De precieze pathologie in PBA is onbekend, maar er is een hypothese dat een hersenzenuw door schade niet meer goed verbonden is met de hersendelen die verantwoordelijk zijn voor de aansturing van de onderhavige emoties. In de literatuur worden bij de verschillende indicaties verschillende gebeurtenissen waargenomen, ook binnen een indicatie. De incidentie kan variëren van tien tot rond de vijftig procent binnen de genoemde indicaties. De variatie die in de verschillende onderzoeken gezien wordt, kan worden verklaard door de aangehouden definitie van PBA. Gevolgen van PBA kunnen zijn het ontwikkelen van sociale angsten of sociaal teruggetrokken gedrag. Daarmee kan het een behoorlijke impact hebben op het welzijn van de patiënt.
Nuedexta® is een combinatiepreparaat van dextromethorfan met kinidine in twee verschillende sterktes.2 Beide middelen zijn ook afzonderlijk op de markt: dextromethorfan als hoestprikkeldempend middel, kinidine als antiaritmicum. De registratie geldt voor alle volwassenen met PBA, maar is alleen getest bij patiënten met MS en ALS.
In de betreffende richtlijnen wordt aangegeven dat bij ALS voor behandeling van dwanglachen of -huilen kan worden gekozen, wanneer de patiënt hier hinder van ondervindt. Mogelijkheden zijn dan amitriptyline of een combinatie van dextromethorfan met kinidine (30/30 mg).3 Ook wordt aangegeven dat deze combinatie niet altijd goed wordt verdragen. In de richtlijn MS wordt alleen de combinatie van dextromethorfan met kinidine aangegeven als mogelijke behandeling.4 Er is onderzoek gedaan naar verschillende antidepressiva en dopaminerge middelen. Alle onderzoeken waren op kleine schaal, maar in het bijzonder de antidepressiva leken effect te hebben.1 Geen van deze middelen is echter geregistreerd voor de behandeling van PBA. De combinatie van dextromethorfan en kinidine is het eerste middel dat wel geregistreerd is.
Farmacologie
Dynamiek
Dextromethorfan, als dextromethorfanhydrobromidemonohydraat, is werkzaam op het centrale zenuwstelsel.2 Het is niet duidelijk welk mechanisme precies verantwoordelijk is voor het effect bij PBA. Er zijn verschillende aangrijpingspunten van dextromethorfan bekend. Het is een sigma-1-receptoragonist, een niet competitieve NMDA-receptorantagonist. Er is affiniteit voor het serotoninetransporteiwit en de 5-HT1B/D-receptor. Als gevolg van binding aan deze receptoren zouden de glutamaattransmissie, monoaminetransmissie en de ionenkanaalfunctie beïnvloed worden.
Het kinidine, als kinidinesulfaatdihydraat, is toegevoegd omdat het een competitieve remmer van CYP2D6 is. CYP2D6 is belangrijk voor de omzetting van dextromethorfan, waardoor de beschikbaarheid hiervan verhoogd wordt. Bij herhaalde toediening van de 23 mg/9 mg (dextromethorfan/kinidine) combinatiedosis werd een bijna twintigvoudige blootstelling aan dextromethorfan gezien vergeleken met personen die alleen dextromethorfan kregen.
Kinetiek
De Cmax van dextromethorfan is 3 tot 4 uur en ongeveer 2 uur voor kinidine. De halfwaardetijd bij de normale metaboliseerders van dextromethorfan is 18,8 uur. Dit kan oplopen tot 45 uur bij langzame metaboliseerders. De halfwaardetijd voor kinidine is 9,6 uur.
Dextromethorfan wordt snel gemetaboliseerd door CYP2D6 tot dextrorfan, een actieve metaboliet die wordt geglucuronideerd en dan renaal geëlimineerd. Onder invloed van kinidine wordt de omzetting door CYP2D6 geremd en dat verandert de eliminatie van dextromethorfan.
Kinidine wordt gemetaboliseerd door CYP3A4. De metaboliet 3-hydroxykinidine is nog ongeveer half zo actief als kinidine met betrekking tot de cardiale effecten. De opname wordt niet beïnvloed door voedsel. De eiwitbinding voor dextromethorfan is 60-70% en voor kinidine 80-89% bij toediening van het combinatieproduct / dit is vergelijkbaar met de de afzonderlijke producten. Er zijn geen aanwijzingen dat leeftijd, geslacht of ras van invloed zijn op de kinetiek. Bij patiënten met een matige leverfunctiestoornis werd een verhoogd distributievolume waargenomen waardoor de eliminatiehalfwaardetijd werd verhoogd. Ook werden meer bijwerkingen bij deze patiënten gezien. Monitoring van patiënten met een leverfunctiestoornis is dus aangewezen.
Onderzoek
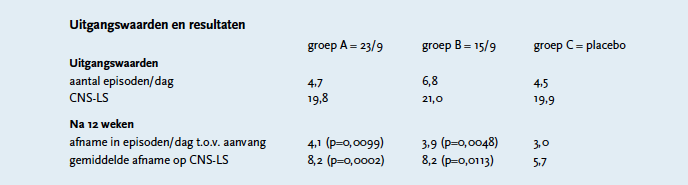
Er is één onderzoek uitgevoerd met de in dextromethorfan/kinidine gebruikte doseringen.5 Hierin zijn 326 patiënten gedurende twaalf weken gerandomiseerd over groep A: 30/10 mg (=23/9 mg) dextromethorfan/kinidine (n=110); groep B: 20/10 mg (=15/9 mg) dextromethorfan/kinidine (n=107) en groep C: placebo (n=109). Alle patiënten waren, naast PBA, bekend met ALS of MS.
Een van de inclusiecriteria was een uitgangsscore voor PBA van 13 of hoger op de Center for Neurologic Study-Lability Score (CNS-LS) die voor PBA is gevalideerd. De verandering in deze score na twaalf weken is als secundair eindpunt meegenomen. Mogelijke scores lopen van 7 tot en met 35. De CNS-LS is een vragenlijst van zeven vragen waarop het optreden van lach- of huilbuien gescoord kan worden tussen 1 (nooit) en 5 (heel vaak). Dit kan zelfstandig door de patiënt worden uitgevoerd. Baseline was het gemiddelde aantal episoden van PBA, gemeten over zeven dagen voor aanvang van de studie. Het verschil in aantal episoden per dag was het primaire eindpunt van de studie. Het gemiddelde aantal episoden voor aanvang van de studie was in groep A 4,7, in groep B 6,8 en in groep C 4,5 (zie tabel). De gemiddelde uitgangsscore op de CNS-LS was voor groep A 19,8, groep B 21,0 en groep C 19,9. Na twaalf weken was het aantal episoden per dag afgenomen, met 4,1, 3,9 en 3,0 voor respectievelijk groep A, B en C. De gemiddelde afname op de CNS-LS, secundair eindpunt, was 8,2 voor de groepen A en B en 5,7 voor de placebogroep. Al deze resultaten zijn significant ten opzichte van placebo.
Naast deze studie zijn er in 2004 en 2006 nog onderzoeken uitgevoerd waarin dextromethorfan en kinidine werden gecombineerd.6 7 In deze beide onderzoeken werd echter 30 mg kinidine gebruikt in plaats van de 10 mg uit de meest recente studie. In het onderzoek uit 2006 werd gedurende twaalf weken dextromethorphan 30 mg/kinidine 30 mg vergeleken met placebo bij 150 MS-patiënten.7 Het primaire eindpunt was het verschil in CNS-LS ten opzichte van de baseline. Dit was significant (p=<0,0001). De andere studie uit 2004 heeft de combinatie van dextromethorfan en kinidine vergeleken met het effect van alleen dextromethorfan of alleen kinidine.6 In totaal waren 140 patiënten bij dit onderzoek betrokken gedurende vier weken. Ook hier vond men een significante reductie op de CNS-LS ten opzichte van alleen dextromethorfan (p=0,001) en alleen kinidine (p=<0,001).
Bijwerkingen
In een onderzoek met 326 PBA-patiënten is de veiligheid van de combinatie van dextromethorfan met kinidine onderzocht tijdens een fase 3-onderzoek. De eerste twaalf weken van het onderzoek zijn blind uitgevoerd in drie groepen, zoals beschreven onder het kopje onderzoek. Daarna is er een verlengingsperiode geweest van twaalf weken, waaraan alle patiënten mochten deelnemen die het onderzoek hadden afgerond (253). Doel was om meer gegevens over de veiligheid van het middel te verzamelen. In dit deel van het onderzoek ontvingen alle deelnemers de sterkte 23 mg/9 mg.
De meest gemelde bijwerkingen hadden betrekking op het maag-darmstelsel (vaak: tussen de 1/10 en 1/100: diarree, misselijkheid), zenuwstelsel (vaak: duizeligheid, hoofdpijn en somnolentie) en vermoeidheid. Ernstige bijwerkingen die werden gemeld zijn spierspasticiteit, ademhalingsdepressie en een verlaagde zuurstofverzadiging in het bloed. In totaal waren er tien patiënten die de studie niet afgemaakt hebben in verband met bijwerkingen. Dit waren 9,3% (15/9 mg) en 5,5% (23/9 mg) uit de twee onderzoeksgroepen tegenover 1,8% van de placebogroep.
In beide andere onderzoeken werd duizeligheid gezien als bijwerking die vaker voorkwam in de combinatiegroep ten opzichte van placebo of de afzonderlijke stoffen. Daarnaast werd in het onderzoek, waarin de combinatie dextromethorfan/kinidine werd vergeleken met aparte behandeling ook vaker diaree, misselijkheid en somnolentie gezien.6 Tijdens het onderzoek staakte 24% de behandeling tegenover 6% van de dextromethorfan- en 5% van de kinidinegroep. In de andere studie staakten 14,5% van de combinatiegroep de behandeling tegenover 10,8% van de placebogroep.7 In alle studies werden vergelijkbare bijwerkingen waargenomen, maar in de eerste studies waren meer patiënten die het gebruik staakten vanwege bijwerkingen.
Interacties
In verband met interacties met MAO-remmers, mag de dextromethorfan/kinidine-combinatie niet gebruikt worden tot veertien dagen na de beëindiging van een MAO-remmer. Er is dan een risico op het serotoninesyndroom. Mao-remmers remmen de afbraak van serotonine en dextromethorfan remt de heropname van serotonine, waardoor via twee verschillende mechanismen serotonine verhoogd wordt.8
Er zijn verschillende interacties met betrekking tot de CYP-enzymen. Het metabolisme van kinidine is afhankelijk van CYP3A4. Onder invloed van het gebruik van CYP3A4-remmers kan de spiegel van kinidine stijgen, met als gevolg een groter risico op QTc-verlenging. Combinatie met sterke en matige remmers van CYP3A4, zoals claritromycine, erytromycine, itraconazol, ketoconazol, fluconazol, verapamil, diltiazem, grapefruitsap en verschillende hiv-middelen moet daarom vermeden worden. Indien dit niet mogelijk is, moet het ecg voor de start en tijdens de behandeling gecontroleerd worden.
Het gebruik van CYP3A4-inductoren kan ervoor zorgen dat kinidine versneld wordt afgebroken. Hierdoor wordt mogelijk CYP2D6 minder geremd, waardoor dextromethorfan ook sneller wordt afgebroken, met als gevolg subtherapeutische plasmaconcentraties van dextromethorfan.
Kinidine is een sterke remmer van CYP2D6. Voor dextromethorfan is dit gewenst, maar ook van andere middelen die een substraat zijn voor CYP2D6, wordt het metabolisme beïnvloed. Niet voor alle middelen is dit onderzocht, maar voor een aantal middelen gelden concrete aanwijzigingen. Vooral met middelen die het QTc kunnen verlengen moet rekening gehouden worden. Daarnaast is voor paroxetine / zelf een remmer en substraat van CYP2D6 / gebleken dat toevoeging van kinidine leidt tot een hogere blootstelling. Hierdoor wordt een lagere aanvangsdosis van paroxetine geadviseerd met een maximumdosis van 35 mg/dag.
Kinidine is een P-glycoproteïne (Pgp)-remmer. Bij toediening van substraten voor Pgp, zoals digoxine, kan een hogere spiegel verwacht worden. Bij digoxine kan de serumspiegel wel twee keer zo hoog zijn. Monitoring van de digoxinespiegel is dus van groot belang bij patiënten die ook Nuedexta® gebruiken. Andere Pgp-subtraten zijn bijvoorbeeld ticagrelor en dabigatran, beide NOAC€™s.
Contra-indicaties
De combinatie van dextromethorfan met kinidine is gecontraïndiciceerd bij de volgende patiënten:2
/ zij die bekend zijn met een kinidine, kinine of mefloquine geïnduceerde trombocytopenie, hepatitis, beenmergdepressie of lupusachtig syndroom;
/ zij die gelijktijdig behandeld worden met kinidine, kinine, mefloquine of thioridazine. Dit laatste middel kan het QT-interval verlengen en wordt hoofdzakelijk door CYP2D6 gemetaboliseerd;
/ patiënten die bekend zijn met een verlengd QT-interval, een congenitaal QT-syndroom, of met een voorgeschiedenis die wijst op torsade des pointes of ventriculaire tachycardie;
/ patiënten met een (groot risico op) volledig atrioventriculair (AV)-blok zonder een geïmplanteerde pacemaker.
Zwangerschap en lactatie
Er is weinig bekend over het gebruik van de combinatie van dextromethorfan en kinidine bij zwangerschap en borstvoeding. Met betrekking tot zwangerschap is in dieronderzoek ontwikkelingstoxiciteit waargenomen. Omdat het schade aan de foetus kan toebrengen, wordt het gebruik afgeraden tijdens zwangerschap en bij vrouwen die zwanger kunnen worden.
Van kinidine is bekend dat dit wordt uitgescheiden in de moedermelk; van dextromethorfan is dit onbekend. Omdat een risico voor zuigelingen kan niet worden uitgesloten, moet het belang van moeder en kind worden afgewogen.
Handelspreparaat, dosering en prijs
De combinatie van dextromethorfan met kinidine wordt onder de merknaam Nuedexta® op de markt gebracht door Jenson Pharmaceuticals Services Ltd als capsules met respectievelijk 15/9 mg en 23/9 mg. De dosering bestaat uit een startdosering van één week eenmaal daags één capsule in de morgen. Daarna wordt de onderhoudsdosering tweemaal daags één capsule. Wanneer het effect na vier weken onvoldoende is, kan worden overgegaan op 23/9 mg tweemaal daags één capsule. De prijs is nog niet bekend.
Conclusie en plaatsbepaling
Tot nu toe bestond voor de behandeling van pseudobulbair affect nog geen geregistreerd middel, waarmee de combinatie van dextromethorfan en kinidine het eerste middel is voor deze aandoening. Met de sterkte die nu is geregistreerd, is maar één onderzoek uitgevoerd. Daarnaast waren er twee onderzoeken waarbij een hogere dosering kinidine is gebruikt. Alle studies laten een significant effect zien op de CNS-LS en een afname van het aantal aanvallen per dag. De onderbouwing voor de werkzaamheid van de nu geregistreerde dosering is niet heel sterk. Met betrekking tot alternatieven, is er een aantal kleine onderzoeken met voornamelijk antidepressiva uitgevoerd, maar geen van deze middelen is geregistreerd voor deze indicatie. Hoewel PBA in de literatuur beschreven wordt als een aandoening die regelmatig tot veel voorkomt wanneer er schade aan de hersenen is opgetreden, is het een relatief onbekend fenomeen. Het is dan ook de vraag in hoeverre dit een plaats krijgt in de dagelijkse praktijk van de openbare apotheek. De combinatie dextromethorfan/kinidine heeft tamelijk veel interacties, in het bijzonder met betrekking tot de CYP-enzymen. Daarnaast zijn er verscheidene contra-indicaties, bijvoorbeeld door verlenging van het QT-interval, waardoor de toepasbaarheid van deze combinatie beperkt is.
Literatuur
1Schiffer R, Pope LE. Review of pseudobulbar affect including a novel and potential therapy. J Neuropsychiatry Clin Neurosci 17:4, Fall 2005 via http://neuro.psychiatryonline.org
2Nuedexta® summary of product characteristics via http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002560/WC500145050.pdf
3Richtlijn ALS 2010 via http://www.pallialine.nl/richtlijn/item/index.php?pagina=/richtlijn/item/pagina.php&richtlijn_id=761
4CBO 2012 via http://www.diliguide.nl/document/992/multiple-sclerose.html
5Pioro EP, Brooks BR et al. Dextromethorphan plus ultra low-dose quinidine reduces Pseudobulbar Affect; Ann. Neurol. 2010 via http://www.biotechinvest.net/uploads/STAR_Trial_Publication_-_Annals_of_Neurology_9-13-10.pdf
6Brooks BR, Thisted RA et al. Treatment of pseudobulbar affect in ALS with dextromethorphan/quinidine A randomized trial. Neurology 2004;63:1364-1370.
7Panitch HS, Thisted RA et al. Randomized, Controlled Trial of Dextromethorphan/Quinidine for Pseudobulbar Affect in Multiple Sclerosis. Ann Neurol 2006;59:780-787.
8Interactie dextromethorfan-MAO-remmers; achtergrondinformatie; via KNMP kennisbank.