Samenvatting
Olodaterol;
meer keuze voor COPD-patiënten
Dyspnoeklachten bij chronic obstructive pulmonary disease (COPD) worden behandeld met bronchusverwijders. Bij matig ernstige tot zeer ernstige COPD kan een onderhoudsbehandeling met een langwerkende bronchusverwijder geïndiceerd zijn. Olodaterol (Striverdi Respimat®) is een nieuwe langwerkende bèta-2-agonist die geregistreerd is voor behandeling van COPD. In klinisch onderzoek werd na 12 en 24 weken behandeling met olodaterol een toename in FEV1 gevonden die significant verschilde van het effect van placebo en vergelijkbaar was met het effect van formoterol. Het effect van olodaterol houdt significant langer aan ten opzichte van placebo en ook ten opzichte van formoterol (significantie onbekend). In een meta-analyse, waarin olodaterol werd vergeleken met indacaterol, werden geen significante verschillen gevonden tussen beide middelen. Als eenmaal daagse toediening van een langwerkende bèta-2-agonist de voorkeur heeft, dan is er nu een extra keuze voor behandelaar en patiënt. Voorlopig lijkt dit een goede extra mogelijkheid voor bepaalde patiënten, maar niet meer dan dat.
Pharma Selecta 2014 (september) nr 10
S.F. Harkes-Idzinga en M. van der Velde, onder medeverantwoordelijkheid van de redactie
Abstract
Dyspnoea in chronic obstructive pulmonary disease (COPD) is treated with bronchodilators, although maintenance therapy with a long-acting bronchodilator might be indicated in moderate to severe COPD. Olodaterol (Striverdi Respimat®) is a new long-acting beta-2-agonist approved for the treatment of COPD. Clinical research showed that the increase in forced expiratory volume in 1 second after 12 and 24 weeks of treatment with olodaterol was significantly different from that achieved with placebo and comparable to that achieved with formoterol. The effect of olodaterol lasted significantly longer than that of placebo and also longer than that of formoterol (significance not known). A meta-analysis of olodaterol and indacaterol found no significant differences between the two drugs. As once-daily dosing of a long-acting beta-2-agonist is the preferred treatment, patients and doctors now have an extra choice. For the moment, olodaterol seems a good additional treatment possibility for some patients, but it is not more than that.
Pharm Sel 2014;30:50-54.
Inleiding
Bij COPD (Chronic Obstructive Pulmonary Disease) is sprake van een chronische luchtwegobstructie die meestal progressief is. Deze obstructie wordt in verband gebracht met een abnormale ontstekingsreactie in de longen op schadelijke deeltjes en gassen. Door parenchymschade (emfyseem) en ontsteking van de kleine luchtwegen (bronchiolitis) ontstaat een obstructie die niet geheel reversibel is. COPD komt vrijwel uitsluitend voor bij rokers van veertig jaar en ouder. In de Nederlandse huisartsenpraktijk is de prevalentie ongeveer twintig per duizend patiënten per jaar. Het aantal nieuwe COPD-gevallen per jaar is ongeveer twee per duizend. De prevalentie en incidentie nemen toe met de leeftijd van de patiënt.1 De mate van luchtstroombeperking bij COPD wordt weergegeven volgens de GOLD-classificatie (zie tabel 1).

Deze classificatie gaat uit van de FEV1 na inhaleren van een adequate dosis van een kortwerkende luchtwegverwijder bij patiënten met een FEV1/FVC-ratio <0,70. De FEV1 is de hoeveelheid lucht die na maximale inademing kan worden uitgeademd in één seconde. De FVC is het volume aan lucht dat wordt uitgeademd na maximale inademing.2
Tabel 1 – GOLD (Global Initiative for Chronic Obstructive Lung Disease)-classificatie voor mate van luchtstroombeperking bij COPD-patiënten, gebaseerd op FEV1 na inhaleren kortwerkende luchtwegverwijder (FEV1/FVC < 0,70)2
Bij de behandeling van COPD worden volgens de NHG-standaard de volgende doelen nagestreefd:1 “Verminderen van de klachten; verbeteren van het inspanningsvermogen; normaliseren van de achteruitgang van de longfunctie (FEV1); voorkómen van exacerbaties; uitstellen of voorkómen van invaliditeit en arbeidsongeschiktheid; verbeteren van de ziektegerelateerde kwaliteit van leven.”
Dyspnoeklachten worden behandeld met bronchusverwijders. Deze hebben bij COPD-patiënten geen invloed op het beloop van de longfunctie, gemeten met behulp van de FEV1.1 De behandeling start met een kortwerkend anticholinergicum of een kortwerkende bèta-2-agonist. Bij onvoldoende effect na twee weken adviseert het NHG om over te stappen op een middel van de andere soort of om dit toe te voegen. Houden de klachten van dyspnoe aan of treden er exacerbaties op bij patiënten met (matig) ernstige COPD (GOLD 2-4), dan wordt een onderhoudsbehandeling gestart met een langwerkende bronchusverwijder. De NHG-standaard noemt geen voorkeur bij licht of matige COPD.1 Volgens de GOLD-richtlijn (richtlijn van het Global Initiative for Chronic Obstructive Lung Disease) voor diagnose, beheersing en preventie van COPD, hangt de keuze af van de beschikbaarheid en de effectiviteit en bijwerkingen. Voor behandeling van dyspnoe bij stabiele COPD geeft de GOLD-richtlijn de voorkeur aan langwerkende bronchusverwijders boven kortwerkende.2
Olodaterol (Striverdi Respimat®)is een nieuwe langwerkende bèta-2-agonist voor behandeling van COPD.3 In dit artikel wordt een plaatsbepaling gegeven van dit middel.
Farmacologie
Dynamiek
Olodaterol heeft een sterke affiniteit en een hoge selectiviteit voor de menselijke bèta-2-receptor. Bèta-2-receptoren komen voornamelijk voor op de gladde spiercellen van de luchtwegen, maar ook op endotheelcellen in het hart en van de longen. Na inhalatie bindt olodaterol aan bèta-2-receptoren in de luchtwegen en activeert deze. Dit leidt tot stimulatie van intracellulair adenylylcyclase. Dit enzym is betrokken bij de vorming van cyclisch-3’,5’ adenosinemonofosfaat (cAMP). Verhoogde concentraties hiervan hebben ontspanning van de gladde spiercellen in de luchtwegen tot gevolg en daarmee bronchusverwijding.3 De werking treedt binnen vijf minuten in en houdt 24 uur aan.4
Kinetiek
Cmax wordt 10-20 minuten na inhalatie bereikt. De absolute biologische beschikbaarheid na inhalatie was 30% bij gezonde vrijwilligers. Het verdelingsvolume is 1110 L. Dit duidt op opname door de weefsels. Olodaterol is substraat voor verschillende transporters, waaronder Pgp. Het wordt gemetaboliseerd tot inactieve metabolieten door CYP2C8 en CYP2C9 en door UGT2B7, UGT1A1, 1A7 en 1A9. Na inhalatie werd bij gezonde vrijwilligers binnen het dosisinterval 5-7% van de toegediende dosis uitgescheiden in de urine als onveranderd olodaterol.3
Klinische studies
In twee multicenter, dubbelblinde, placebo-gecontroleerde studies, 1222.11 en 1222.12 (zie tabel 2), werd de effectiviteit en veiligheid van olodaterol per inhalatie ten opzichte van placebo onderzocht.5 De studies werden gefinancierd door de fabrikant. In beide studies werden patiënten met matig tot zeer ernstige COPD (GOLD 2-4) gerandomiseerd naar behandeling met olodaterol 5 of 10 microgram per dag of placebo gedurende in totaal 48 weken. Olodaterol werd toegediend als inhalatievloeistof met de Respimat®. Inclusiecriteria waren: leeftijd tenminste 40 jaar en een rookhistorie van meer dan 10 pakjaren (1 pakjaar = 20 sigaretten per dag gedurende één jaar1). De belangrijkste exclusiecriteria waren een voorgeschiedenis van astma, een belangrijke aandoening anders dan COPD, myocardinfarct in de anamnese of ziekenhuisopname wegens hartfalen in het voorgaande jaar, instabiele of levensbedreigende hartritmestoornis en regelmatig gebruik van zuurstoftherapie overdag. Gebruik van onderhoudsmedicatie voor COPD, anders dan langwerkende bèta-2-agonisten, was toegestaan tijdens de studie. Voor gebruik van langwerkende bèta-2-agonisten werd een wash-out-periode van 48 uur aangehouden. Alle patiënten kregen salbutamol als noodmedicatie. Op dag 1 en in week 6 en 12 werden één uur voor inhalatie van olodaterol of placebo longfunctietesten uitgevoerd, waarbij FEV-1 en FVC werden gemeten. Dit werd 10 minuten voor inhalatie van het toegewezen middel herhaald. De gemiddelde FEV1-waarde uit deze metingen vormde de zogenaamde dal-FEV1. Met de dal-FEV1 werd de dal-FEV1-respons bepaald, de verandering in dal-FEV1 ten opzichte van baseline.
In studie 1222.11 bestond de olodaterol-5 mcg-groep uit 208 patiënten, de olodaterol 10 mcg-groep uit 207 en de placebogroep uit 209 patiënten. In studie 1222.12 waren deze groepsgroottes respectievelijk 209, 217 en 216. Van de patiënten in de placebogroep stopte 24% voortijdig met studie 1222.11 en 17% in elk van de behandelgroepen. Voor studie 1222.12 waren deze percentages respectievelijk 19, 11 en 17 in de placebogroep, de olodaterol 5 mcg-groep en de olodaterol 10 mcg-groep. De gemiddelde FEV1 bij de start van studie 1222.11 (baseline) was in de olodaterol 5 mcg-groep 1,13 L, in de oldaterol 10 mcg-groep 1,20 L en in de placebogroep 1,17 L. In studie 1222.12 was de gemiddelde FEV1 bij start van de studie in de olodaterol 5 mcg-groep 1,21 L, in de 10 mcg-groep 1,17 L en in de placebogroep 1,20 L.
Het eerste primaire eindpunt in beide studies was de AUC0-3u voor de verandering FEV1 ten opzichte van baselinena 12 weken behandeling. In studie 1222.11 was deze waarde 0,165 ± 0,014 L in de olodaterol 5 mcg-groep, 0,169 ± 0,014 L in de olodaterol 10 mcg-groep en -0,007 ± 0,014 L in de placebogroep (voor beide olodaterolgroepen: p<0,0001 versus placebo). In studie 1222.12 was deze waarde 0,159 ± 0,013 L in de olodaterol 5 mcg-groep, 0,152 ± 0,013 L in de 10 mcg-groep en 0,008 ± 0,013 L in de placebogroep (voor beide olodaterolgroepen: p<0,0001 versus placebo).
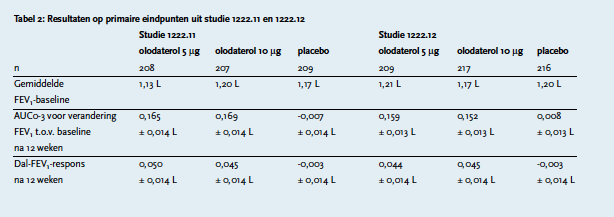
Het tweede primaire eindpunt was de dal-FEV1-respons na 12 weken behandeling. In studie 1222.11 was dit in de olodaterol 5 mcg-groep 0,050 ± 0,014 L, in de olodaterol 10 mcg-groep 0,060 ± 0,014 L en in de placebogroep -0,041 ± 0,014 L (voor beide olodaterolgroepen p<0,0001 ten opzichte van placebo). In studie 1222.12 was de dal-FEV1-respons in de olodaterol 5 mcg-groep 0,044 ± 0,014 L , in de olodaterol 10 mcg-groep 0,045 ± 0,014 L en in de placebogroep -0,003 ± 0,014 L (olodaterol 5 mcg: p<0,05 ten opzichte van placebo, olodaterol 10 mcg: p<0,01 ten opzichte van placebo). Bij analyse van de gecombineerde gegevens van beide studies werd geen statistisch significante invloed van behandeling met tiotropium gevonden.
In twee andere multicenter, dubbelblinde, placebo-gecontroleerde studies, 1222.13 en 1222.14 (tabel 3), werd de effectiviteit en veiligheid van olodaterol per inhalatie ten opzichte van placebo en formoterol onderzocht.6 De studies werden gefinancierd door de fabrikant. In beide studies werden patiënten met matig tot zeer ernstige COPD (GOLD 2-4) gerandomiseerd naar behandeling met olodaterol 5 of 10 mcg per dag, formoterol tweemaal daags 12 mcg of placebo gedurende in totaal 48 weken. Olodaterol werd toegediend als inhalatievloeistof met de Respimat®, formoterol via de Aerolizer®, een inhalator voor inhalatiecapsules. In- en exclusiecriteria waren vergelijkbaar met de eerder genoemde studies 1222.11 en 1222.12. Gebruik van onderhoudsmedicatie voor COPD, anders dan langwerkende bèta-2-agonisten, was toegestaan tijdens de studie. Alle patiënten kregen salbutamol als noodmedicatie. Op dag 1 en in week 2, 6 en 12 werden één uur voor inhalatie van geneesmiddel of placebo longfunctietesten uitgevoerd, waarbij FEV-1 en FVC werden gemeten. Dit werd 10 minuten voor inhalatie van het toegewezen middel herhaald. De gemiddelde FEV1-waarde uit deze metingen vormde de zogenaamde dal-FEV1. In de overige studieweken werd de dal-FEV1 bepaald door de FEV1 10 minuten voor inhalatie te meten. Met de dal-FEV1 werd de dal-FEV1-respons bepaald, de verandering in dal-FEV1 ten opzichte van baseline. In studie 1222.13 bestond de olodaterol 5 mcg-groep uit 227 patiënten, de olodaterol 10 mcg-groep uit 225, de formoterolgroep uit 227 en in de placebogroep waren het er 225. In studie 1222.14 waren deze groepsgroottes respectievelijk 232, 234, 233 en 235. De gemiddelde FEV1 bij de start van studie 1222.13 (baseline) was 1,44 L in de olodaterol 5 mcg-groep, 1,36 L in de olodaterol 10 mcg-groep, 1,44 L in de formoterolgroep en 1,39 L in de placebogroep. De gemiddelde FEV1 bij de start van studie 1222.14 was 1,42 L in de oldaterol 5 mcg-groep, 1,41 L in de oldaterol 10 mcg-groep, 1,36 L in de formoterolgroep en 1,41 L in de placebogroep.
Het eerste primaire eindpunt in beide studies was de AUC0-3u voor de verandering FEV1 ten opzichte van baselinena 24 weken behandeling. In studie 1222.13 was de waarde van dit eindpunt in de olodaterol 5 mcg-groep 0,142 ± 0,015 L, in de olodaterol 10 mcg-groep 0,156 ± 0,015 L, in de formoterolgroep 0,168 ± 0,015 L en in de placebogroep -0,009 ± 0,016 L (voor alle groepen p<0,0001 versus placebo). In studie 1222.14 was de waarde van dit eindpunt 0,116 ± 0,014 L in de olodaterol 5 mcg-groep, in de olodaterol 10 mcg-groep 0,140 ± 0,014 L, in de formoterolgroep 0,137 ± 0,014 L en in de placebogroep -0,013 ± 0,014 L (voor alle groepen p<0,0001 versus placebo).
Het tweede primaire eindpunt was de dal-FEV1-respons na 24 weken behandeling. De waarde voor dit eindpunt was in studie 1222.13 in de olodaterol 5 mcg-groep 0,021 ± 0,015 L (p<0,001 versus placebo), in de olodaterol 10 mcg-groep 0,028 ± 0,015 L (p<0,0001 versus placebo), in de formoterolgroep -0,002 ± 0,015 L (p<0,01 versus placebo) en in de placebogroep -0,056 ± 0,015 L. In studie 1222.14 was de waarde voor dit eindpunt in de olodaterol 5 mcg-groep -0,003 ± 0,014 L (p<0,01 versus placebo), in de olodaterol 10 mcg-groep 0,014 ± 0,014 L (p<0,001 versus placebo), in de formoterolgroep –0,013 ± 0,014 L (p<0,05 versus placebo) en in de placebogroep -0,055 ± 0,014 L.
Het derde primaire eindpunt was een score voor de mate van dyspnoe, de Mahler transition dyspnea index (TDI) focal score na 24 weken. Voor de analyse van dit eindpunt werden de resultaten van beide studies samengenomen. In geen van de behandelgroepen werd op dit eindpunt een significant verschil gevonden ten opzichte van placebo. De auteurs wijten dit aan een onverwachte verbetering in de placebogroep in één van beide studies. De resultaten op dit eindpunt zijn daardoor volgens de auteurs niet vergelijkbaar en combinatie hiervan in de analyse geeft daarom geen betrouwbaar resultaat.
Bij analyse van de gecombineerde gegevens van beide studies werd geen statistisch significante invloed van behandeling met tiotropium gevonden.

In een meta-analyse werd indirect de effectiviteit van olodaterol vergeleken met die van indacaterol, een bèta-2-agonist die net als olodaterol eenmaal daags wordt gedoseerd.7 Dagelijkse doses van 75 of 150 mcg indacaterol werden vergeleken met een dagelijkse dosis van 5 mcg olodaterol. Er werden geen statistisch significante verschillen gevonden.
Bijwerkingen
Olodaterol is op de markt toegelaten onder aanvullende monitoring. Aan zorgverleners wordt gevraagd vermoedelijke bijwerkingen te melden.
In klinische onderzoeken zijn de volgende bijwerkingen gemeld. Soms: nasofaryngitis, duizeligheid en huiduitslag. Zelden: hypertensie en gewrichtspijn. Omdat olodaterol een bèta-2-agonist is, moet volgens de fabrikant rekening worden gehouden met bijwerkingen van deze geneesmiddelgroep.3
Interacties
Als olodaterol gelijktijdig wordt toegediend met xantinederivaten, steroïden of niet-kaliumsparende diuretica kan volgens de fabrikant het kaliumverlagend effect worden verhoogd. Bètablokkers kunnen het effect van olodaterol verminderen. Als bètablokkers geïndiceerd zijn, kan een cardioselectief middel worden gekozen. Tricyclische antidepressiva, MAO-remmers en QT-verlengende middelen kunnen het effect van olodaterol op het hartvaatstelsel versterken.3
Contra-indicaties
Bij overgevoeligheid voor olodaterol of een van de hulpstoffen in de inhalatievloeistof is dit middel gecontraïndiceerd. Olodaterol is een bèta-2-agonist. Voorzichtigheid is daarom geboden bij patiënten met cardovasculaire aandoeningen, epilepsie, thyreotoxicose of verlenging van het QT-interval. Bij sommige patiënten kan bij gebruik van bèta-2-agonisten hypokaliëmie optreden. Inhalatie van hoge doses kan leiden tot verhoogde glucoseplasmaspiegels.3
Zwangerschap en lactatie
Er is geen informatie beschikbaar over gebruik van olodaterol door zwangere vrouwen. In dierstudies zijn geen aanwijzingen gevonden voor schadelijke effecten met betrekking tot de voortplanting. Olodaterol kan net als andere bèta-2-agonisten weeën remmen. Zwangeren moeten olodaterol bij voorkeur niet gebruiken. In dieronderzoek is waargenomen dat olodaterol overgaat in de moedermelk. Het is onbekend of dit bij de mens ook het geval is. Bij een dosering van 5 mcg per dag is de systemische blootstelling verwaarloosbaar en zijn geen relevante effecten bij het kind te verwachten. De fabrikant raadt aan om ofwel met de borstvoeding te stoppen, ofwel de behandeling met olodaterol te staken of te onderbreken tijdens de lactatieperiode.3
Voorlichting aan de patiënt
Olodaterol, in patronen voor de Respimat®-inhalator, kan alleen worden gebruikt met de Respimat®. Zoals voor alle inhalatiemedicatie is een gebruiksinstructie nodig. De inhalator kan drie maanden worden gebruikt en moet daarna worden weggegooid, ook als de patroon nog niet helemaal leeg is. De patiënt moet het mondstuk van de inhalator tenminste eenmaal per week schoonmaken met een vochtige doek of tissue.3
Handelspreparaat, dosering en prijs
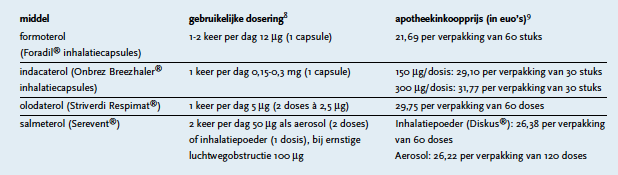
Olodaterol voor inhalatie wordt op de markt gebracht door Boehringer Ingelheim onder de naam Striverdi Respimat®. Het is geregistreerd als bronchusverwijdende onderhoudsbehandeling bij COPD. De aanbevolen dosering is 5 mcg per dag, toe te dienen als twee inhalaties na elkaar, steeds op hetzelfde tijdstip.3 In de tabel staat een overzicht van de apotheekinkoopprijzen van verschillende langwerkende bèta-2-agonisten die worden toegepast als onderhoudsbehandeling bij COPD.
Conclusie en plaatsbepaling
In klinisch onderzoek werd na 12 en 24 weken behandeling met olodaterol een toename in FEV1 gevonden. Deze toename verschilde significant ten opzichte van behandeling met placebo en was vergelijkbaar bij behandeling met formoterol. Het effect van olodaterol houdt significant langer aan ten opzichte van placebo en ook langer ten opzichte van het effect van formoterol (significantie onbekend). De patiënten die in de beschreven onderzoeken waren geïncludeerd hadden matig-ernstige tot zeer ernstige COPD (GOLD 2-4) en gebruikten naast de studiemedicatie hun gebruikelijke COPD-medicijnen (met uitzondering van langwerkende bèta-2-agonisten). Daarmee is rekening gehouden met het feit dat in de praktijk verschillende bronchusverwijders naast elkaar worden gebruikt – ook door patiënten met (zeer) ernstige COPD.
In een meta-analyse waarin olodaterol werd vergeleken met indacaterol werden geen significante verschillen gevonden tussen beide middelen. Olodaterol hoeft vanwege zijn lange werkingsduur slechts eenmaal daags te worden gebruikt – dat kan een voordeel zijn voor sommige patiënten. De prijs is vergelijkbaar met die van andere langwerkende bèta-2-agonisten die worden toegepast bij COPD, uitgaande van de specialité’s. Op dit moment is in Nederland één andere langwerkende bèta-2-agonist op de markt die eenmaal daags wordt gedoseerd en als monopreparaat beschikbaar is, namelijk indacaterol. Er is slechts één indirecte vergelijking tussen olodaterol en indacaterol beschikbaar.
Als eenmaal daagse toediening van een langwerkende bèta-2-agonist de voorkeur heeft, dan is er nu een extra keuze voor behandelaar en patiënt. Voorlopig lijkt dit een goede extra mogelijkheid voor bepaalde patiënten, maar niet meer dan dat. De keuze voor een bronchusverwijder hangt bij COPD-patiënten af van verschillende factoren, waaronder het effect van een bepaald type bronchusverwijder en de mogelijkheden van de patiënt om bepaalde typen inhalatoren wel of niet te gebruiken.
Literatuur
1 Smeele IJM, Weel C van et al. NHG-standaard COPD (Tweede herziening). Huisarts Wet 2007;50;362-379.
2 From the Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2014. Available from: http://www.goldcopd.org/.
3 SPC Striverdi, RVG 112058, 4-9-2013.
4 Zorginstituut Nederland. Farmacotherapeutisch Kompas. Geraadpleegd via www.farmacotherapeutischkompas.nl, 24 augustus 2014.
5 Ferguson GT, Feldman GJ et al. Efficacy and safety of olodaterol once daily delivered via Respimat® in patients with GOLD 2-4 COPD: results from two replicate 48-week studies. Int J Chron Obstruct Pulmon Dis 2014;9:629-645.
6 Koch A, Pizzichini E et al. Lung function efficacy and symptomatic benefit of olodaterol once daily deliverd via Respimat® versus placebo and formoterol twice daily in patients with GOLD 2-4 COPD: results from two replicate 48-week studies. Int J Cron Obstruct Pulmon Dis 2014;9:697-714.
7 Roskell NS, Anzueto A et al. Once-daily long-acting beta-agonists for chronic obstructive pulmonary disease: an indirect comparison of olodaterol and indacaterol. Int J Cron Obstruct Pulmon Dis 2014;9:813-824.
8 Informatorium Medicamentorum op KNMP Kennisbank augustus 2014.
9 KNMP Kennisbank, onderdeel Prijs en Logistiek, augustus 2014.