Samenvatting
Calcitonin-gene related peptide (CGRP) is een neuropeptide dat een belangrijke rol speelt bij de ontstekingsprocessen en vasodilatatie die bij migraine plaatsvinden. Erenumab (Aimovig®) is het eerste CGRP-receptorantagonist monoklonale antilichaam voor de profylaxe van migraine. In de meeste onderzoeken was erenumab op de belangrijkste primaire en secundaire eindpunten circa tweemaal zo effectief als placebo. Dit is vergelijkbaar met de effectiviteit van andere middelen voor migraineprofylaxe. Erenumab was ook effectief bij patiënten die geen respons hadden op eerdere preventietherapieën en bij patiënten met chronische migraine. In de registratiestudies werd het goed verdragen, maar de langetermijneffecten van CGRP-suppressie zijn nog niet bekend. Erenumab lijkt een aanvulling op het huidige arsenaal aan middelen voor de profylaxe van migraine, al is de prijs wel veel hoger. Vooralsnog lijkt erenumab daarom alleen voor patiënten bij wie de huidige behandelmogelijkheden niet aanslaan of niet worden verdragen.
A. Heersche en M.A. Bijlstra-Cramer, onder medeverantwoordelijkheid van de redactie
Abstract
The neuropeptide calcitonin gene-related peptide (CGRP) has an important role in the inflammatory processes and vasodilatation that occur during migraine. Erenumab (Aimovig®) is the first monoclonal antibody of the CGRP receptor for the prevention of migraine. In the majority of studies, erenumab was roughly twice as effective as placebo on the most important primary and secondary endpoints. This is comparable to the effect of other drugs for migraine prevention. However, erenumab is also in effective in patients resistant to earlier preventive treatments and in patients with chronic migraine. It was tolerated well in the registration studies, but the long-term effects of CGRP suppression are not known. Erenumab would seem a welcome addition to the current arsenal of drugs for migraine prevention, although it is much more expensive. For the moment, erenumab should be reserved for patients in whom existing treatment possibilities are ineffective or not tolerated.
Pharma Selecta 2018 (september) Pharm Sel 2018;34:65-68.
Inleiding
Migraine is een neurovasculaire aandoening, waarbij aanvalsgewijs hevige hoofdpijnepisodes optreden. De hoofdpijn is meestal unilateraal en pulserend. Patiënten hebben daarnaast vaak last van misselijkheid en een verhoogde gevoeligheid voor licht en geluid. Een aanval duurt 4 tot 72 uur. De frequentie verschilt per patiënt. De prevalentie van migraine in de algemene bevolking bedraagt ongeveer vijftien procent, en komt vaker voor bij vrouwen dan bij mannen.[1,2]
De medicamenteuze behandeling van migraine bestaat uit twee benaderingen: aanvals- en profylactische therapie. Voor de behandeling van de aanvallen worden vooral NSAID’s en de specifiek voor migraine ontwikkelde triptanen gebruikt. Profylactische behandeling komt in aanmerking als er meer dan twee aanvallen per maand optreden. De NHG-Standaard Hoofdpijn adviseert hiervoor als eerste keus een bètablokker en als tweede valproïnezuur of topiramaat.[1] Patiënten hebben niet altijd voldoende baat bij de huidige behandelmogelijkheden of ervaren teveel bijwerkingen.[2]
Calcitonin-gene related peptide (CGRP) is een neuropeptide dat een belangrijke rol speelt bij de ontstekingsprocessen en vasodilatatie die bij migraine plaatsvinden. Er zijn diverse niet-peptide CGRP-antagonisten ontwikkeld (groepsnaam: gepants), maar die zijn (nog) niet op de markt verschenen. Bij de meeste is de productie inmiddels gestaakt, onder andere vanwege optreden van levertoxiciteit. Erenumab is het eerste CGRP-receptorantagonist monoklonale antilichaam voor de behandeling van migraine. Andere CGRP-antagonisten (galcanezumab, eptinezumab en fremanezumab) zijn in ontwikkeling. Deze grijpen aan op CGRP en verhinderen zo de binding van dit ligand aan de receptor.[2,3] In juli 2018 is erenumab door de European Medicines Agency (EMA) goedgekeurd voor registratie onder de merknaam Aimovig®.
Farmacologie
Dynamiek
De pathofysiologie van migraine is complex en niet geheel bekend. Het trigemino-vasculaire systeem speelt een belangrijke rol in het pijnproces dat gedurende de aanval optreedt. Dit systeem bestaat uit trigeminale nuclei in de hersenstam, het trigeminale ganglion, de eerste tak van de trigeminale zenuw en bloedvaten en nociceptoren in de hersenvliezen. Vermoedelijk begint de hoofdpijnfase van een aanval met activatie van het trigemino-vasculaire systeem. Dit kan leiden tot de afgifte van diverse neuropeptides, waaronder CGRP. Dit wordt gesynthetiseerd en afgegeven in diverse perifere en centrale neuronen, maar komt vooral voor in de trigeminale neuronen. Het grijpt aan op de CGRP-receptor – een zeer krachtige vasodilatator – en het moduleert nociceptieve pijnsignalering. Tijdens een migraineaanval neemt de CGRP-spiegel toe en deze normaliseert weer als de hoofdpijn afneemt. Erenumab is een humaan monoklonaal antilichaam dat bindt aan het CGRP-receptorcomplex. Hierdoor verhindert het de binding van CGRP aan de receptor.[2,3,4]
Kinetiek
De geschatte biologische beschikbaarheid na subcutane toediening bedraagt 82%. Na een enkelvoudige dosis wordt de Cmax bereikt na vier tot zes dagen. Erenumab wordt grotendeels gemetaboliseerd via een niet-specifieke proteolytische route. De eliminatiehalfwaardetijd bedraagt 28 dagen.[4]
Klinisch onderzoek
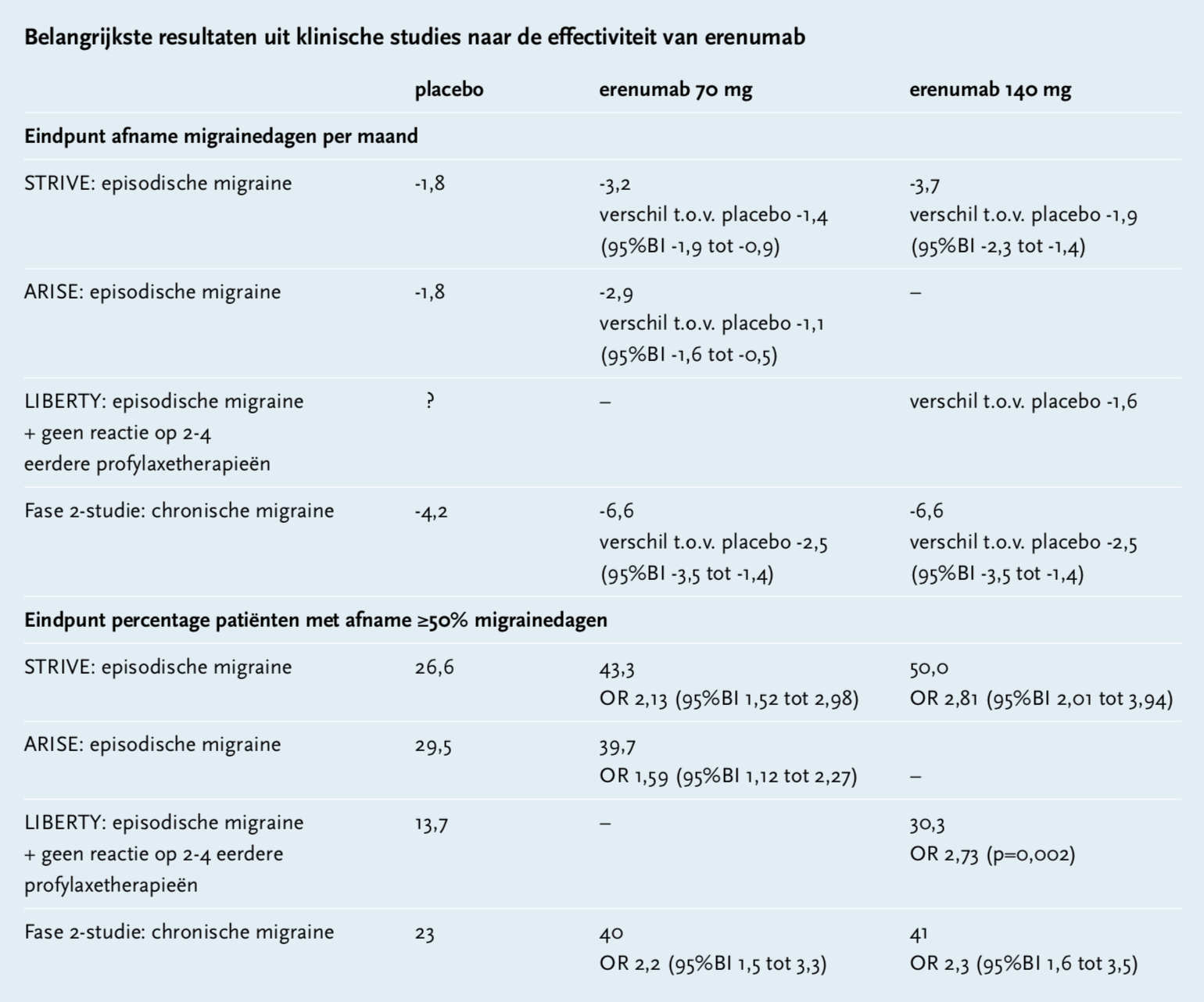
Er zijn drie dubbelblinde, gerandomiseerde, placebo-gecontroleerde fase 3-studies naar de klinische effectiviteit van het subcutaan toegediende erenumab uitgevoerd: ARISE, STRIVE en LIBERTY. Deze studies werden uitgevoerd bij patiënten met episodische migraine (≥4 en <15 migrainedagen per maand). Daarnaast is er een fase 2-onderzoek uitgevoerd naar patiënten met chronische migraine (≥15 hoofdpijndagen per maand, waarvan ten minste ≥8 migrainedagen). De belangrijkste resultaten uit deze onderzoeken staan ook in de tabel weergegeven.
STRIVE was een studie bij 955 migrainepatiënten. Het primaire eindpunt was de verandering in het aantal migrainedagen per maand vanaf baseline tot maand 4-6 van de behandeling. Een van de secundaire eindpunten was een vermindering van 50% of meer in het aantal migrainedagen/maand. Er werd gerandomiseerd over erenumab 70 mg/maand (n=317), erenumab 140 mg/maand (n=319) en placebo (n=319) gedurende 24 weken. Het aantal migrainedagen/maand bij baseline was voor alle groepen 8,3. De groepen behandeld met erenumab hadden een significante vermindering van het aantal migrainedagen/maand ten opzichte van placebo: voor 70 mg -3,2 versus -1,8 dagen (verschil -1,4 dagen; 95%BI -1,9 tot -0,9) en voor 140 mg -3,7 versus -1,8 dagen (verschil -1,9 dagen; 95%BI -2,3 tot -1,4). Een afname van ≥50% van het aantal migrainedagen/maand was 26,6% bij placebo, 43,3% bij erenumab 70 mg (OR 2,13; 95%BI 1,52 tot 2,98) en 50,0% bij erenumab 140 mg (OR 2,81; 95%BI 2,01 tot 3,94). Van de patiënten voltooide 90% deze fase van de studie. De uitval was vergelijkbaar tussen de drie groepen.[4,5]
De ARISE-studie werd uitgevoerd bij 577 migrainepatiënten, waarbij alleen de 70 mg-dosering is onderzocht. De primaire en secundaire eindpunten waren dezelfde als in het STRIVE-onderzoek. Patiënten werden gerandomiseerd over erenumab 70 mg (n=286) of placebo (n=291) gedurende 12 weken. Het aantal migrainedagen/maand bij baseline was voor de placebogroep 8,4 en voor de erenumabgroep 8,1. De groep behandeld met erenumab had een significante vermindering van het aantal migrainedagen/maand ten opzichte van placebo: -2,9 versus -1,8 (verschil −1,1; 95%BI -1,6 tot -0,5). Een afname van ≥50% van het aantal migrainedagen/maand was 29,5% voor placebo en 39,7% voor erenumab (OR 1,59; 95%BI 1,12 tot 2,27).[6]
Een kanttekening bij het STRIVE en ARISE-onderzoek is dat patiënten die geen respons hadden op meer dan twee eerdere profylactische therapieën voor migraine, werden geëxcludeerd. De moeilijk behandelbare patiënten zijn dus uitgesloten in deze onderzoeken. De LIBERTY-studie is juist uitgevoerd bij migrainepatiënten die niet reageerden op twee tot vier eerdere profylactische therapieën. In deze studie is alleen de 140 mg dosering onderzocht. Patiënten (n=246) werden gerandomiseerd over erenumab 140 mg/maand en placebo gedurende 12 weken. Het primaire eindpunt was een vermindering in het aantal migrainedagen/maand van 50% of meer. In week 12 was dit bereikt bij 30,3% van de patiënten met erenumab versus 13,7% bij placebo (OR 2,73; p=0,002). De groep behandeld met erenumab had een significante vermindering van het aantal migrainedagen/maand ten opzichte van placebo: -1,6. De resultaten van deze studie zijn nog niet gepubliceerd.[7,8,9]
In een fase 2-studie is de effectiviteit van erenumab onderzocht bij patiënten met chronische migraine. Patiënten kregen placebo (n=286), erenumab 70 mg/maand (n=191) of erenumab 140 mg/maand (n=190) gedurende 12 weken. Het gemiddelde aantal migrainedagen/maand bij baseline was voor alle groepen ongeveer 18. Bij beide erenumabgroepen nam het aantal migrainedagen/maand af met -6,6 dagen en bij placebo met -4,2 dagen (verschil -2,5 dagen; 95%BI -3,5 tot -1,4). Een afname van ≥50% van het aantal migrainedagen/maand was 23% voor placebo, 40% voor erenumab 70 mg (OR 2,2; 95%BI 1,5 tot 3,3) en 41% voor erenumab 140 mg (OR 2,3; 95%BI 1,6 tot 3,5).[4,10] Een subgroepanalyse van deze studie vergeleek specifiek de effectiviteit tussen patiënten met en zonder historie van falende preventietherapie. In deze subgroepanalyse was de vermindering van het aantal migrainedagen/maand en afname van ≥50% vergelijkbaar tussen patiënten zonder eerder therapie falen, bij ≥1 falende therapie en bij ≥2 falende therapieën. Daarnaast werd ook gekeken naar een reductie van ≥75% van het aantal migrainedagen/maand. Bij patiënten bij wie ≥2 therapieën faalden was dat 3,5% voor placebo, 11,1% voor erenumab 70 mg (OR 3,6; 95%BI 1,2 tot 10,9) en 21,7% voor erenumab 140 mg (OR 8,0; 95% BI 2,8 tot 23,0). Patiënten zonder respons op >3 profylactische therapieën werden geëxcludeerd in deze studie.[4,11]
Bijwerkingen
De SmPC noemt als vaakst gemelde bijwerkingen van erenumab voor de doseringen van 70 mg en 140 mg: injectieplaatsreacties (pijn, erytheem en pruritus bij 5,6% respectievelijk 4,5% van de gebruikers), obstipatie (1,3 en 3,2%), spierspasmen (0,7 en 2,0%) en pruritus (1,0 en 1,8%). In studies ontwikkelde 6,3% van de patiënten met een dosering van 70 mg en 2,6% met 140 mg antilichamen tegen erenumab. Dit had geen invloed op de werkzaamheid of veiligheid. Tot nu toe zijn er geen aanwijzingen voor levertoxiciteit.[4]
In een studie uitgevoerd onder patiënten met stabiele angina pectoris was een eenmalige intraveneuze toediening van erenumab 140 mg niet inferieur aan placebo op het gebied van afname van de Total Exercise Time (TET).[12]
Interacties
Erenumab heeft geen invloed op CYP-enzymen of transporters en geeft waarschijnlijk geen interacties met andere geneesmiddelen.[4]
Contra-indicaties
Overgevoeligheid voor het werkzame bestanddeel of voor een van de hulpstoffen is een contra-indicatie voor gebruik van erenumab. De dop van de injectiespuit/pen bevat latex; dit kan allergische reacties veroorzaken bij patiënten die daar overgevoelig voor zijn.
Er is geen dosisaanpassing nodig bij patiënten met een verminderde lever- of nierfunctie. Erenumab is niet onderzocht bij een verminderde leverfunctie. De lever is echter nauwelijks betrokken bij de eliminatie, en erenumab wordt als monoklonaal antilichaam niet via CYP-enzymen afgebroken. Erenumab is niet onderzocht bij patiënten met ernstige nierinsufficiëntie. Bij patiënten met een lichte en matige nierinsufficiëntie werd geen verschil in de farmacokinetiek gezien ten opzichte van patiënten met een normale nierfunctie.[4]
Zwangerschap en lactatie
Er is weinig onderzoek gedaan naar gebruik van erenumab tijdens de zwangerschap. Uit dieronderzoek kwamen geen directe of indirecte schadelijke effecten naar voren. Uit voorzorg wordt gebruik tijdens de zwangerschap afgeraden.
Het is niet bekend of erenumab wordt uitgescheiden in de moedermelk. Het advies is om de eerste paar dagen na de geboorte geen borstvoeding te geven bij gebruik van erenumab. Daarna kan men borstvoeding tijdens gebruik overwegen.[4]
Voorlichting aan de patiënt
De patiënt moet erenumab in principe bewaren in de koelkast, al kan het in de buitenverpakking tot 14 dagen buiten de koelkast bewaard blijven. Vanwege lichtgevoeligheid moeten de spuiten en pennen tot het moment van toedienen in de buitenverpakking blijven. De fabrikant adviseert om de injectiespuit of pen minimaal 30 minuten voor toedienen uit de koelkast te halen, zodat de injectievloeistof op kamertemperatuur is voordat deze wordt toegediend. De voorgevulde spuit of pen mag men niet schudden voor gebruik. De patiënt kan de injecties zelf toedienen in de buik of het bovenbeen. Indien een andere persoon de injectie toedient, kan dit ook in de bovenarm. Het is belangrijk de injectieplaats af te wisselen. Elke voorgevulde spuit of pen is voor eenmalig gebruik en moet helemaal worden leeggespoten.[4]
Handelspreparaten, dosering en prijs
Erenumab wordt onder de naam Aimovig® geleverd door de firma Novartis Pharma. Het is geregistreerd voor profylaxe van migraine bij volwassenen die ten minste vier migrainedagen per maand hebben.
Erenumab is verkrijgbaar als oplossing voor injectie in een voorgevulde spuit of pen voor eenmalige toediening. Een spuit of pen bevat 70 mg erenumab. Andere bestanddelen van de injectievloeistof zijn sacharose, polysorbaat 80, natriumhydroxide, ijsazijn en water voor injecties.
De aanbevolen dosis is 70 mg, toe te dienen als subcutane injectie, eenmaal per vier weken. Indien nodig kan dit worden opgehoogd naar 140 mg. Er is geen dosisaanpassing nodig bij oudere patiënten.[4]
Op dit moment is nog niet bekend wat erenumab gaat kosten en of het wordt opgenomen in het geneesmiddelvergoedingssysteem (GVS). De verwachte kosten per patiënt per jaar liggen tussen de 5.000 en 10.000 euro.[13]
Conclusie en plaatsbepaling
Erenumab is een nieuw subcutaan toe te dienen geneesmiddel voor de profylaxe van migraine. In tegenstelling tot de huidige therapieën voor migraineprofylaxe heeft het een werkingsmechanisme, dat specifiek is gericht op de pathofysiologie van migraine. In gecontroleerd onderzoek bleek het effectief bij de profylaxe van migraine. In de meeste onderzoeken was erenumab circa tweemaal zo effectief als placebo in de vermindering van het aantal migrainedagen per maand of in een reductie van ≥50% van het aantal migrainedagen. Dit is vergelijkbaar met de effectiviteit van andere middelen voor migraineprofylaxe.[1] Erenumab was ook effectief bij patiënten die geen respons hadden op eerdere preventietherapieën en bij patiënten met chronische migraine. Voor sommige patiënten kan het middel dus wellicht wel een verschil maken. In de registratiestudies werd erenumab goed verdragen. Het is echter nog niet bekend wat de langetermijneffecten zijn van CGRP-suppressie.
Erenumab lijkt een aanvulling op het huidige arsenaal aan geneesmiddelen voor de profylaxe van migraine. Voor een meer definitieve plaatsbepaling is verder onderzoek nodig om de effectiviteit en veiligheid op de lange termijn te beoordelen en erenumab direct te vergelijken met andere profylactische geneesmiddelen toegepast bij migraine. Het is nog niet duidelijk hoeveel erenumab exact gaat kosten. De prijs zal veel hoger liggen dan die van de huidige middelen. Vooralsnog lijkt erenumab daarom alleen een optie voor patiënten bij wie de huidige profylactische behandelmogelijkheden niet aanslaan of niet worden verdragen.
Literatuur
1. NHG-Standaard Hoofdpijn derde herziening (geraadpleegd via https://www.nhg.org).
2. Maasumi K, Michael RL, Rapoport AM. CGRP and migraine: the role of blocking calcitonin gene-related peptide ligand and receptor in the management of migraine. Drugs 2018;78:913-928.
3. Edvinsson L, Agmund Haanes K, Warfvinge K et al. CGRP as the target of new migraine therapies - successful translation from bench to clinic. Nat Rev Neurol 2018;14:338-350.
4. SmPC Aimovig®, 16-08-2018 (geraadpleegd via http://www.ema.europa.eu).
5. Goadsby PJ, Reuter U, Hallström Y et al. A controlled trial of erenumab for episodic migraine. N Engl J Med 2017;377:2123-2132.
6. Dodick DW, Ashina M, Brandes JL et al. ARISE: A phase 3 randomized trial of erenumab for episodic migraine. Cephalalgia 2018;38:1026-1037.
7. https://clinicaltrials.gov/ct2/show/NCT03096834, geraadpleegd 26-08-2018.
8. Medical Letter Novartis 17 april 2018 (geraadpleegd via https://novartis.gcs-web.com/static-files/37a68c7c-3675-42f7-a6d5-b0d9c034927c).
9. Markham A. Erenumab: first global approval. Drugs 2018;78:1157-1161.
10. Tepper S, Ashina M, Reuter U et al. Safety and efficacy of erenumab for preventive treatment of chronic migraine: a randomised, double-blind, placebo-controlled phase 2 trial. Lancet Neurol 2017;16:425-434.
11. Ashina M, Tepper S, Brandes JL et al. Efficacy and safety of erenumab (AMG334) in chronic migraine patients with prior preventive treatment failure: A subgroup analysis of a randomized, double-blind, placebo-controlled study. Cephalalgia 2018 Jan 1:333102418788347.
12. Depre C, Antalik L, Starling A et al. A randomized, double-Blind, placebo-controlled study to evaluate the effect of erenumab on exercise time during a treadmill test in patients with stable angina. Headache 2018;58:715-723.
13. https://www.horizonscangeneesmiddelen.nl (geraadpleegd 11-09-2018).