Samenvatting
Triple-therapie bij chronic obstructive pulmonary disease (COPD) heeft een plek in de GOLD-klasse D. Hieronder vallen patiënten die, ondanks het gebruik van duo-therapie (een langwerkend bèta-mimeticum [LABA] + een inhalatiecorticosteroïd [ICS] of een LABA + een langwerkende muscarine-antagonist [LAMA]), klachten houden met veel inflammatie. Sinds juli 2017 is Trimbow® met beclometason, formoterol en glycopyrronium (BDP/FF/GB) in aerosol geregistreerd in een extrafijne formulering. Het is inmiddels voor vergoeding beschikbaar op Nederlandse markt. Bij patiënten met symptomatische COPD, ernstige of zeer ernstige beperking van de luchtstroom en een exacerbatiegeschiedenis ondanks onderhoudstherapie, verminderde extra-fijne BDP/FF/GB de hoeveelheid matig tot ernstig significante exacerbaties in vergelijking met een combinatie van LAMA+LABA of indacaterol+glycopyrronium. Het feit dat er met BDP/FF/GB een fixed triple beschikbaar is, zou op theoretische gronden het gebruiksgemak en de therapietrouw – en daarmee de controle van de COPD – bevorderen. Uit de gedane TRINITY-studie blijkt dit voordeel niet. Wel is een fixed triple voordeliger dan de afzonderlijke combinaties bij elkaar.
E.C. Weening, M.M.M. de Vooght, onder medeverantwoordelijkheid van de redactie
Abstract
Triple therapy is advised for the treatment of GOLD stage D chronic obstructive pulmonary disease (COPD). These patients experience symptoms and severe airway inflammation despite duo therapy with a long-acting beta agonist (LABA) plus inhaled corticosteroid (ICS), or a LABA plus a long-acting muscarinic antagonist (LAMA). Trimbow®, a drug containing an extrafine formulation of beclometasone, formoterol, and glycopyrronium (BDP/FF/GB), was approved in July 2017 and its costs are reimbursed in the Netherlands. In patients with symptomatic COPD, severe or very severe airflow limitations, and a history of exacerbations despite maintenance therapy, extrafine BDP/FF/GB decreases the number of moderate-to-severe exacerbations when compared with a combination of a LAMA plus LABA or indacaterol plus glycopyrronium. The availability of this fixed triple therapy should theoretically facilitate medication use and compliance and hence COPD control. While the TRINITY study failed to demonstrate this advantage, it should be noted that fixed triple therapy is cheaper than the individual ingredients combined.
Pharma Selecta 2019 (april) Pharm Sel 2019;35:22-25.
Inleiding
Chronic obstructive pulmonary disease (COPD) wordt gekenmerkt door een niet-volledig reversibele en doorgaans progressieve luchtwegobstructie die het gevolg is van een – in het algemeen door roken veroorzaakt – chronisch inflammatoir proces, gelokaliseerd in de centrale en perifere luchtwegen, het longparenchym en de pulmonale bloedvaten.[1] Bij dit inflammatoire proces is er een infiltratie van voornamelijk neutrofielen en macrofagen. De voortdurende schade aan de longen, zelfs na het stoppen van de trigger, wordt waarschijnlijk in stand gehouden door CD8+ T-lymfocyt gemedieerde inflammatie. Er is een toename van oxidatieve stress door zuurstofradicalen uit sigarettenrook, mogelijk andere vervuilende stoffen, neutrofielen en macrofagen. Deze inflammatie leidt tot fibrose van het parenchym en overvloedige toename van bronchiale mucussecretie. Daarnaast vinden histologische veranderingen plaats en is door apoptose van endotheel- en alveolaire cellen de capaciteit van de longen om te herstellen beperkt.[2] Dit leidt vervolgens tot progressieve bronchusobstructie, hypersecretie van mucus en hyperinflatie (‘tonvormige thorax’), en uiteindelijk tot gaswisselingsstoornissen, emfyseem, pulmonale hypertensie en cor pulmonale. In sommige gevallen kan de chronische ontsteking en hyperreactiviteit persisteren, ondanks het stoppen met roken. Bij ongeveer 10% van de patiënten met COPD ontstaan metabole en systemische veranderingen – een gestoorde eiwitbalans en afname van de spiermassa – die leiden tot een verminderde voedingstoestand.[1]
Rond de 95% van alle patiënten met COPD in de ontwikkelde landen zijn of waren rokers. Er is een grote variatie in afname van de longfunctie in deze groep: rond 10-20%, met een versnelde afname door onder andere genetische aanleg.[2] De relatie tussen passief roken en een verminderde longfunctie is minder duidelijk. Passief roken leidt wel tot meer luchtwegklachten.[1] Andere risicofactoren voor het ontstaan van COPD zijn luchtvervuiling, ook binnenshuis, blootstelling aan organische en anorganische stoffen en dampen, armoede en astma.[2,3]
COPD ontwikkelt zich pas na jarenlang roken. Er is een duidelijke relatie tussen de totale tabaksconsumptie en de ernst van de longfunctievermindering.[1] In 2017 overleden in Nederland 6.820 personen ten gevolge van COPD, en is daarmee de zesde doodsoorzaak na respectievelijk dementie, longkanker, beroerte, coronaire hartziekten en hartfalen.[4]
De behandeling van COPD heeft tot doel het beperken van de klachten, verbetering van het inspanningsvermogen alsook de kwaliteit van leven en het verlagen van toekomstige ziektelast, zoals het normaliseren van de achteruitgang van de longfunctie, het voorkomen van exacerbaties en uitstellen of voorkomen van invaliditeit, arbeidsongeschiktheid en mortaliteit. Medicamenteuze interventies alleen hebben een beperkt effect op klachten, inspanningsvermogen, kwaliteit van leven en exacerbaties – zij dienen altijd gecombineerd te worden met niet-medicamenteuze maatregelen.[1]
Op dit moment zijn de behandelopties voor COPD beperkt tot een klein aantal farmacologische klassen: de bronchusverwijders (kortwerkende bèta-mimetica [SABA], langwerkend bèta-mimetica [LABA], kortwerkende muscarine-antagonisten [SAMA] en langwerkende muscarine-antagonisten [LAMA]), inhalatiecorticosteroïden (ICS) en theofylline.[1,3,5] Therapie met langwerkende luchtwegverwijders verbetert de longfunctie en patient-reported outcomes (PRO), zoals symptomen en kwaliteit van leven, inspanningstolerantie en vermindering van het aantal exacerbaties.[5] De combinatie van een LABA en LAMA is effectiever dan monotherapie in het verbeteren van de PRO. Tevens is er bewijs voor minder exacerbaties bij gebruik van twee langwerkende luchtwegverwijders in plaats van één. Ook is het toevoegen van een ICS aan een LABA effectief in het reduceren van de PRO en de exacerbatiefrequentie.[5]
Afhankelijk van de ernst van de COPD wordt in de GOLD-richtlijn 2019 gestart met een LABA of een LAMA. Bij blijvende benauwdheid wordt geswitcht naar een combinatie van een LABA en een LAMA. Bij twee of meer exacerbaties per jaar wordt een LABA gecombineerd met een ICS in plaats van de combinatie LABA+LAMA. Bij aanhoudende klachten en veel inflammatie, GOLD-klasse D, wordt een triple-therapie van LABA+LAMA+ICS ingezet.[5]
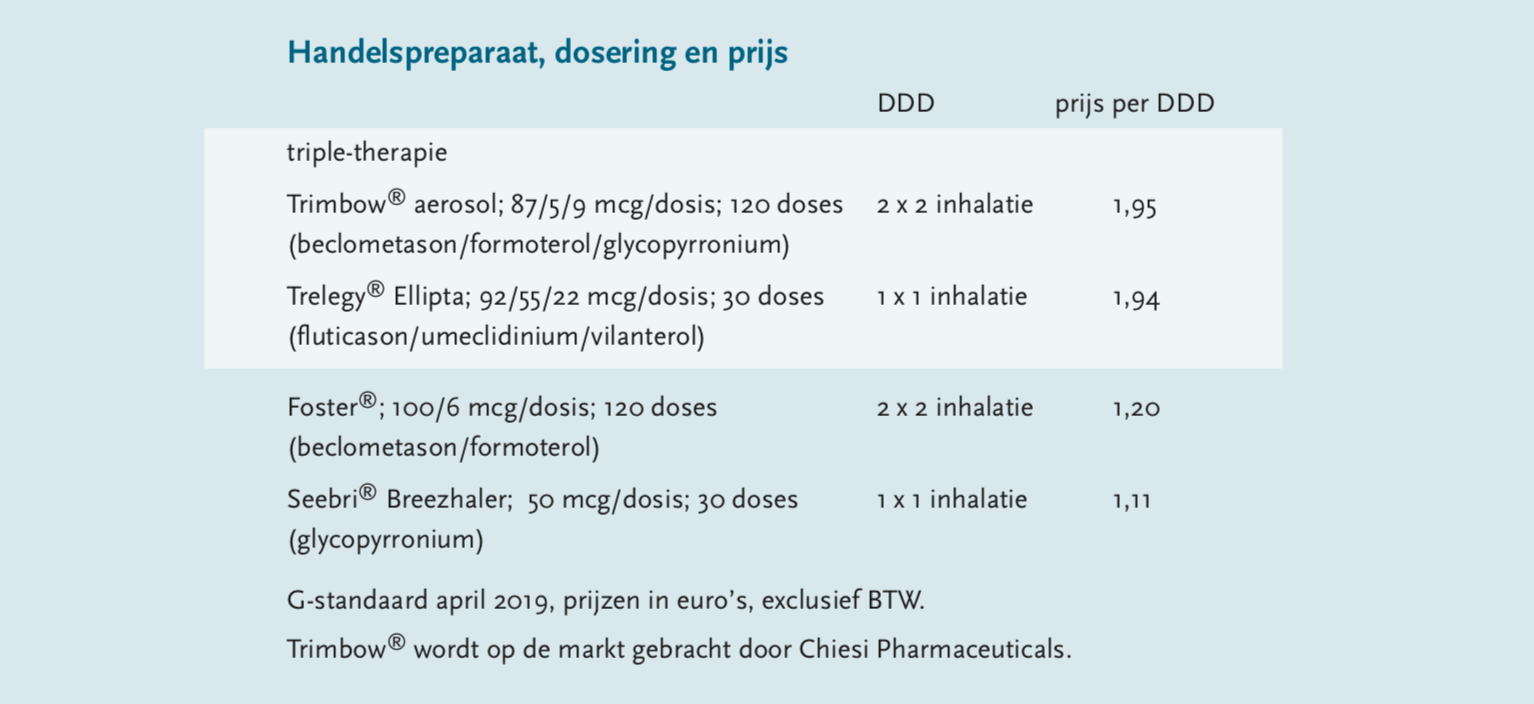
Momenteel zijn twee handelspreparaten beschikbaar met een triple-therapie. Het betreft de Trimbow®-aerosol (beclometason, formoterol en glycopyrronium) van Chiesi Pharmaceuticals en Trelegy® Ellipta-poederinhalator (fluticason, umeclidinium en vilanterol) van GlaxoSmithKline. Beide zijn geregistreerd voor onderhoudsbehandeling van volwassenen met matig tot ernstige COPD, waarbij een combinatie van ICS+LABA (of LAMA+LABA in het geval van Trelegy®) onvoldoende effectief is.[6] In dit artikel wordt Trimbow® besproken.
Farmacologie
Dynamiek
De combinatie beclometason, formoterol en glycopyrronium (BDP/FF/GB) aerosol is een formulering met extrafijne deeltjes met een diameter van circa één micrometer en een gelijktijdige afgifte van de drie werkzame bestanddelen. De aerosoldeeltjes zijn veel kleiner dan die bij niet-extrafijne formuleringen. Voor beclometasondipropionaat leidt dit tot een sterker effect: 100 microgram beclometason in een extrafijne formulering komt overeen qua werkzaamheid met 250 microgram in een niet-extrafijne formulering.
Beclometason heeft ontstekingsremmende, glucocorticoïde eigenschappen. De werking wordt gemedieerd door de binding aan glucocorticoïdreceptoren in het cytoplasma, resulterend in de verhoogde transcriptie van genen die coderen voor anti-inflammatoire eiwitten.
Formoterol is een selectieve bèta-2-adrenerge agonist die de gladde spieren van de bronchiën ontspant.
Glycopyrronium is een langwerkende muscarinereceptorantagonist met een hoge selectiviteit voor de M3-receptor.[6]
Kinetiek
De systemische blootstelling aan de afzonderlijke bestanddelen in BDP/FF/GB zijn vergelijkbaar met de beclometason/formoterol-combinatie (Foster®) en glycopyrronium afzonderlijk. Het gebruik van BDP/FF/GB met een Aero-Chamber Plus®-voorzetkamer verhoogt de maximale plasmaconcentratie van beclometason, formoterol en glycopyrronium in de longen met respectievelijk 15, 58 en 60%. De totale systemische blootstelling (AUC) verandert met gebruik van de voorzetkamer voor beclometason met -37%, voor formoterol met -24% en voor glycopyrronium met +45%.
Beclometasondipropionaat wordt door esterase-enzymen in het longweefsel omgezet in het actieve monopropionaat. Van het systemisch beschikbare beclometasonmonopropionaat is 36% afkomstig van de geïnhaleerde dosis via de longen en de rest van de ingeslikte dosis via het maag-darmkanaal; de biologische beschikbaarheid hiervan is verwaarloosbaar. De presystemische conversie tot monopropionaat in de longen leidt tot een systemische absorptie van 41% van de totale dosis. Eliminatie vindt voornamelijk plaats via excretie met de feces. De eliminatiehalfwaardetijd bedraagt 0,5 en 2,7 uur voor respectievelijk beclometasondipropionaat en -monopropionaat.
Ook formoterol wordt na inhalatie voor een deel geabsorbeerd uit de longen en het maag-darmkanaal. De fractie van een geïnhaleerde dosis die is doorgeslikt na toediening met een inhalator, kan variëren tussen de 60 en 90%. Tenminste 65% van deze fractie wordt opgenomen in de systemische circulatie. De werking treedt na inhalatie binnen één tot drie minuten in en duurt twaalf uur na een enkelvoudige dosis. De eliminatiehalfwaardetijd bedraagt twee tot drie uur na orale toediening. Het metabolisme van formoterol kent twee belangrijke routes: directe conjugatie in de lever, en O-demethylering via CYP2D6, -2C19 en -2C9.
Glycopyrronium heeft een quarternaire ammoniumstructuur, waardoor opname vanuit maag-darmkanaal zeer beperkt is. De biologische beschikbaarheid vanuit de longen bedraagt 10,5% van de dosis. De totale biologische beschikbaarheid is 12,8% na inhalatie van de dosis. Glycopyrronium wordt in de lever gehydroxyleerd door CYP2D6. De eliminatiehalfwaardetijd bedraagt vijf tot twaalf uur bij een steady-state situatie.[6]
Klinische studies
In de multicenter, dubbelblind, gerandomiseerde, placebo-gecontroleerde cross-over TRIDENT-studie (n=178) is de toevoeging van glycopyrroniumbromide (GB) aan de combinatie beclomethasondipropionaat en formoterolfumaraat (BDP/FF) bij COPD-patiënten onderzocht.[7] De volgende inclusiecriteria waren van toepassing: een post-luchtwegverwijder forced expiratory volume in one second (FEV1)/forced vital capacity (FVC) ratio <0,7, een post-luchtwegverwijder FEV1 tussen de 30 en 60% van de voorspelde waarde en een toename van de FEV1 van tenminste 60 mL, dertig minuten na inhalatie van ipratropiumbromide. De primaire uitkomstmaat betrof het aantonen van superioriteit van het toevoegen van GB aan tweemaal daags twee inhalaties BDP/FF (100/6 microgram) versus BDP/FF alleen op de FEV1 AUC van 0 tot 12 uur op dag zeven. GB is onderzocht met een dosering van tweemaal daags een inhalatie met 12,5, 25 en 50 microgram. De FEV1 AUC 0-12h op dag zeven scoorde met de combinatie GB/BDP/FF 0,087 tot 0,112 L hoger dan met BDP/FF (p<0,001). Op basis van deze studie werd vastgesteld dat GB in een dosering van 25 microgram het beste effectiviteits-veiligheidsprofiel heeft.
In de dubbelblind gecontroleerde, parallel opgezette, gerandomiseerde TRINITY-studie bij 2.691 COPD-patiënten is het effect onderzocht van monotherapie LAMA met een fixed triple (LAMA+LABA+ICS) en open triple (LABA+ICS met los een LAMA) op het voorkomen van exacerbaties.[8] Inclusiecriteria waren onder andere post-luchtwegverwijder FEV1 <50% en tenminste één matig tot ernstige exacerbatie in de afgelopen twaalf maanden. Gedurende een inloopperiode van twee weken ontvingen de patiënten monotherapie met eenmaal daags één inhalatie van 18 microgram tiotropium. Na twee weken werden de patiënten verdeeld in respectievelijk tiotropium mono, fixed triple (tweemaal daags twee inhalaties BDP/FF/GB, 100/6/12,5 μg) en open triple (tweemaal daags twee inhalaties BDP/FF, 100/6 microgram) + eenmaal daags één inhalatie tiotropium 18 microgram. Primair eindpunt betrof de frequentie van matig tot ernstige COPD-exacerbaties. Fixed triple bleek superieur ten opzichte van monotherapie tiotropium qua exacerbaties. De exacerbatiefrequentie was 0,46 (0,41-0,51) respectievelijk 0,57 (0,52-0,63). Relatieve risico was 0,8 (95%BI 0,69-0,92; p=0,025) ten gunste van de fixed triple. Ten opzichte van open triple werd met fixed triple geen verschil waargenomen. Bijwerkingen bleken gelijkwaardig in de drie groepen.
In de multicenter TRIBUTE-studie, gerandomiseerd, parallel opgezet, dubbelblind en dubbel-dummy, is het effect onderzocht van triple-therapie met LAMA+LABA+ICS versus duo-therapie van LAMA+LABA op het voorkomen van matige tot ernstige exacerbaties bij COPD-patiënten.[9] Inclusiecriteria omvatte patiënten met symptomatische COPD, ernstige tot zeer ernstige luchtstroombeperking, ten minste één matige tot ernstige exacerbatie in het voorgaande jaar en inhalatie-onderhoudsmedicatie. Na een run-in van twee weken met één inhalatie per dag van indacaterol/glycopyrronium (IND/GLY, 85/43 microgram) werden patiënten willekeurig toegewezen (1:1) om 52 weken behandeling te ontvangen met tweemaal daags twee inhalaties van beclometason/formoterol/glycopyrronium (BDP/FF/GB, 100/6/10 microgram) of één inhalatie per dag van IND/GLY, 85/43 microgram). Het primaire eindpunt was het aantal matige tot ernstige exacerbaties in 52 weken behandeling bij alle gerandomiseerde patiënten die ten minste één dosis van het onderzoeksgeneesmiddel ontvingen. Er kregen 1.532 patiënten BDP/FF/GB (n=764) of IND/GLY (n=768). Matige tot ernstige exacerbaties traden per jaar 0,50 keer per patiënt op (95%BI 0,45-0,57) voor BDP/FF/GB en 0,59 keer (0,53-0,67) voor IND/GLY met een effectiviteitsratio van 0,848 (0,723-0,995; p=0,043) ten gunste van BDP/FF/GB. Bijwerkingen werden gemeld door 490 (64%) van de patiënten die BDP/FF/GB kregen en 516 (67%) bij IND/GLY. Longontsteking kwam voor bij 28 (4%) patiënten die BDP/FF/GB kregen tegenover 27 (4%) bij IND/GLY.
De TRIDENT-, TRINITY- en TRIBUTE-studies zijn alle gesponsord door Chiesi Pharmaceuticals
Bijwerkingen
Vaak optredende bijwerkingen (1-10%) zijn infecties, zoals pneumonie, faryngitis, orale candidiasis, urineweginfecties of nasofaryngitis en ook hoofdpijn en dysfonie. Soms (0,1-1%) worden gemeld salpingitis, aritmieën, hyperemie, hypertensie, hoesten, diarree, droge mond, dysfagie, dyspepsie, spierspasmen, myalgie, vermoeidheid, infecties zoals griep, gastro-enteritis of sinusitis, alsmede granulocytopenie, hypokaliëmie, hyperglykemie, rusteloosheid, tremor en duizeligheid.[6]
Interacties
Niet-cardioselectieve bètablokkers moeten worden vermeden bij gebruik van formoterol. Het gebruik van L-dopa, L-thyroxine en alcohol kan leiden tot verminderde tolerantie van het hart met betrekking tot de bèta-2-mimetica. Trimbow® bevat een kleine hoeveelheid ethanol en geeft een theoretische kans op interactie met disulfiram of metronidazol.[6]
Contra-indicaties
Voorzichtigheid is geboden bij patiënten met hartritmestoornissen, ernstige hartziekte of verlengd QTc-interval.
Vanwege de formoterol is voorzichtigheid geboden met kalium verlagende medicatie. Hierdoor stijgt de kans op ernstige hypokaliëmie.
Glycopyrronium moet met voorzichtigheid worden gebruikt bij patiënten met prostaathyperplasie of urineretentie.[6]
Zwangerschap en lactatie
BDP/FF/GB mag alleen tijdens de zwangerschap worden gebruikt indien het voordeel voor de patiënt opweegt tegen het mogelijke risico voor de foetus. Zuigelingen en pasgeborenen van moeders die aanzienlijke hoeveelheden BDP/FF/GB krijgen, moeten worden gevolgd op bijniersuppressie.
Borstvoeding wordt afgeraden omdat formoterol en glycopyrronium in kleine hoeveelheden kunnen overgaan in de moedermelk en omdat glycopyrronium de borstvoeding kan onderdrukken.[6]
Discussie en conclusie
Triple-therapie bij COPD heeft een plek in GOLD-klasse D. Hieronder vallen patiënten die, ondanks het gebruik van duo-therapie (LABA+ICS of LABA+LAMA) klachten houden met veel inflammatie. Sinds juli 2017 is Trimbow® met beclometason, formoterol en glycopyrronium (BDP/FF/GB) in aerosol geregistreerd in een extrafijne formulering, en is voor vergoeding al enige tijd beschikbaar op de Nederlandse markt. BDP/FF/GB is geregistreerd in een onderhoudsdosering van tweemaal daags twee inhalaties, bij voorkeur via de AeroChamber® Plus. Sinds november 2017 is ook Trelegy® Ellipta op de markt als formulering waarbij drie afzonderlijke componenten aanwezig zijn: fluticason, vilanterol en umeclidinium. Dit is een droog-poeder-inhalatieapparaat en kan eenmaal daags gebruikt worden. Het voordeel van een fixed triple is het gebruik van één device waarin zowel een LABA, een LAMA als een ICS aanwezig is.
Bij patiënten met symptomatische COPD, ernstige of zeer ernstige beperking van de luchtstroom en een exacerbatiegeschiedenis ondanks onderhoudstherapie, verminderde extra-fijne BDP/FF/GB het aantal van matig tot ernstig significante exacerbaties in vergelijking met LAMA+LABA-combinatie van indacaterol+glycopyrronium. Het relatief risico hierbij was 0,85 ten gunste van BDP/FF/GB. De incidentie van bijwerkingen en pneumonieën bleek in beide groepen gelijk. Ten opzichte van tiotropium alleen is BDP/FF/GB effectiever in het voorkomen van exacerbaties met een relatief risico van 0,8. Ten opzichte van een vaste combinatie formoterol+beclometason en apart glycopyrronium werd geen superioriteit aangetoond. Een vergelijking tussen BDP/FF/GB en de combinatie fluticason, vilanterol en umeclidinium is niet uitgevoerd.
COPD-patiënten in GOLD-klasse D zijn kwetsbaar en behoeven veel zorg en aandacht. Afhankelijk van de ernst van de klachten komt een triple-therapie bij deze patiënten in aanmerking. De keuze hiervoor in de GOLD-richtlijn wordt nog bevestigd door de resultaten in de TRIBUTE-studie met BDP/FF/GB. Het feit dat er met deze formulering een fixed triple beschikbaar is, zou op theoretische gronden het gebruiksgemak en de therapietrouw en daarmee de controle van de COPD bevorderen. Uit de TRINITY-studie blijkt dit voordeel niet. Wel is een fixed triple voordeliger dan de afzonderlijke combinaties bij elkaar. De keuze van arts en patiënt voor Trimbow® of Trelegy® zou bepaald kunnen worden door het soort device – de eerstgenoemde kan gecombineerd worden met een voorzetkamer – en het verschil in dosering.
Literatuur
1. NHG Standaard COPD 2015. https://www.nhg.org/standaarden/volledig/nhg-standaard-copd (geraadpleegd op 4 april 2019).
2. Waller DG, Sampson AP. Medical Pharmacology & therapeutics. Elsevier, 5th edition 2018, hoofdstuk 12.
3. Global Initiative for Chronic Obstructive Lung Disease (GOLD) Guideline 2019. www.goldcopd.org
4. https://www.volksgezondheidenzorg.info/onderwerp/copd/cijfers-context/sterfte#node-sterfte-copd-naar-leeftijd-en-geslacht (geraadpleegd 4 april 2019), https://www.volksgezondheidenzorg.info/ranglijst/ranglijst-doodsoorzaken-op-basis-van-sterfte (geraadpleegd 4 april 2019).
5. Singh D, Corradi M et al. Triple therapy in COPD: new evidence with the extrafine combination of beclometasone dipropionate, formoterol fumarate, and glycopyrronium bromide. Int J Chron Obstruct Pulmon Dis 2017;12:2917-2928.
6. SMPC Trimbow, EMEA/H/C/004257 - II/0002, https://www.ema.europa.eu/en/documents/product-information/trimbow-epar-product-information_en.pdf (geraadpleegd 4 april 2019).
7. Singh D, Schroeder-Babo W et al. The bronchodilator effects of extrafine glycopyrronium added to combination treatment with beclometasone dipropionate plus formoterol in COPD: A randomised crossover study (the TRIDENT study). Respir Med 2016;114:84-90.
8. Vestbo J, Papi A et al. Single-inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double blind, parallel group, randomized controlled trial. Lancet 2017;389:1919-1929.
9. Papi A, Vestbo J et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet 2018;391:1076-1084.