Samenvatting
Zonisamide (Zonegran®) is geregistreerd als toevoeging aan de standaardmedicatie bij de behandeling van volwassenen met epilepsie - al dan niet met secundair gegeneraliseerde aanvallen. Het anti-epilepticum is onderzocht in een viertal studies waarvan er twee van dusdanig korte duur waren dat er geen conclusies konden worden verbonden aan de werkzaamheid van het middel. In de andere twee studies verminderde zonisamide de aanvalsfrequentie bij patiënten met partiële epilepsie significant ten opzichte van placebo. In een meta-analyse werd aangetoond dat een reductie van het aantal aanvallen met tenminste 50 procent 2 tot 2,4 keer vaker voorkwam bij gebruikers van 300 tot 500 mg zonisamide per dag ten opzichte van placebo. Het anti-epilepticum kan eenmaal daags gedoseerd worden en heeft geen relevante interacties op CYP450-niveau. Helaas is er geen head-to-head onderzoek gepubliceerd waarin de werkzaamheid van zonisamide werd vergeleken met andere adjuvante anti-epileptica. Ondanks dat het middel al sinds 1989 in Japan op de markt is, zijn er onvoldoende gegevens over de werkzaamheid en effectiviteit bij kinderen, ouderen en bij patiënten met een verminderde nierfunctie. Dit alles in ogenschouw genomen is de plaats van zonisamide als toevoeging aan de standaardmedicatie beperkt.
M.M.M. Geleedst-de Vooght en H.T. Ensing, onder medeverantwoordelijkheid van de redactie
Abstract
Zonisamide (Zonegran®) is approved as add-on to standard treatment for adults with epilepsy with or without secondary generalized seizures. The antiepileptic drug has been investigated in four studies, two of which were too short to enable conclusions to be drawn about efficacy. The other two studies showed a significant reduction compared with placebo in seizure frequency in adults with partial-onset seizures. A meta-analysis showed that a minimal 50% reduction in seizure frequency occurred 2 - 2.4-times more often in patients receiving zonisamide (300 - 500 mg) than in patients receiving placebo. Dosing is once daily and there are no relevant CYP450 drug interactions. To date, no head-to-head studies have compared the efficacy of zonisamide with that of other adjuvant anti-epileptic drugs. Even though the drug has been available in Japan since 1989, there are insufficient data over its action and efficacy in children, older patients, and patients with a diminished renal function. Taken together, zonisamide has a limited place as add-on to standard treatment.
Pharm Sel 2011;27:38-41.
Inleiding
Epilepsie is een chronische, neurologische aandoening die wordt gekenmerkt door het optreden van aanvallen die plotseling optreden en van voorbijgaande aard zijn. Een epileptische aanval wordt meestal veroorzaakt door kortdurende, overmatige en synchrone ontladingen van een groep neuronen in de cerebrale cortex. De diagnose wordt gesteld wanneer de patiënt tenminste één laat-symptomatische aanval - veroorzaakt door een langer bestaande onderliggende structurele hersenafwijking - of twee niet-geprovoceerde aanvallen heeft gehad. In Nederland worden meer dan 80.000 mensen behandeld voor epilepsie. Jaarlijks worden er 5.000 tot 8.100 nieuwe ziektegevallen gediagnosticeerd. De incidentie is relatief hoog bij kinderen, neemt daarna af en stijgt weer op latere leeftijd.1
Epileptische aanvallen kunnen op verschillende wijzen tot uiting komen. Partiële aanvallen treden op bij 70% van de epilepsiepatiënten en ontstaan door plaatselijke elektrische ontladingen. De symptomen die optreden zijn afhankelijk van het hersendeel, waardoor er sprake kan zijn van motorische verschijnselen zoals trekkingen van een arm of been en smakkende mondbewegingen, waarnemingsstoornissen en psychische en autonome verschijnselen. Er kan onderscheid worden gemaakt tussen de eenvoudige en complexe partiële vorm. Het verschil is dat bij de eenvoudige vorm géén en bij de complexe vorm wél bewustzijnsveranderingen optreden. Een partiële aanval kan overgaan in een secundair gegeneraliseerde aanval. Hierbij worden plotseling alle hersencellen door elektrische ontladingen geprikkeld. Twee belangrijke vormen van gegeneraliseerde epilepsie zijn absences en de tonisch-clonische aanvallen. Daarnaast zijn er ook niet classificeerbare vormen van epilepsie.2
De Nederlandse Vereniging voor Neurologie heeft een richtlijn opgesteld voor de behandeling van epilepsie.1 Medicamenteuze behandeling wordt doorgaans gestart bij twee of meer aanvallen binnen één jaar of na een status epilepticus. De keuze van het anti-epilepticum wordt bepaald door het epilepsiesyndroom, het type aanvallen, de te verwachten effectiviteit en bijwerkingen, de behoeften van de individuele patiënt en factoren als comorbiditeit en comedicatie. De middelen van eerste keus bij partiële aanvallen zijn carbamazepine, oxcarbazepine, natriumvalproaat en lamotrigine. Middelen van tweede keus zijn clobazam, fenytoïne, gabapentine, levetiracetam en topiramaat. Bij onvoldoende effectiviteit van het eerstekeusmiddel of het optreden van onaanvaardbare bijwerkingen, verdient het de voorkeur om een alternatief anti-epilepticum te starten zonder het eerste middel uit te sluipen (add-on). Idealiter wordt bij een gunstig effect van het tweede middel het eerste langzaam afgebouwd vanwege het risico op onttrekkingsinsulten of status epilepticus. Als het tweede middel niet effectief is moet dit worden uitgeslopen en vervangen door een volgend add-on-anti-epilepticum. Deze werkwijze wordt steeds herhaald totdat de optimale therapie is bereikt. Pas nadat twee of drie pogingen tot monotherapie hebben gefaald, gaat men over tot polytherapie. Na drie tot vier mislukte pogingen met verschillende regimes is de therapie waarschijnlijk resistent. Epilepsiechirurgie valt dan te overwegen.1
In Nederland is onlangs door fabrikant Eisai zonisamide op de markt gebracht onder de merknaam Zonegran®. Het middel is geregistreerd als toevoeging aan de standaardmedicatie bij het behandelen van volwassenen met partiële epilepsie met of zonder secundair generaliseerde aanvallen.3 In dit artikel wordt ingegaan op de vraag of zonisamide een nuttige toevoeging is aan het arsenaal van anti-epileptica.
Farmacologie
Dynamiek
Zonisamide is een benzisoxazoolderivaat en heeft in vitro een zwakke koolzuuranhydraseactiviteit. Het werkingsmechanisme van zonisamide is niet geheel opgehelderd. Het middel heeft een effect op spanningsgevoelige natrium- en calciumkanalen. Hierdoor wordt de verspreiding van ontladingen die verantwoordelijk zijn voor de epileptische aanval, geremd en de epileptogene focusactiviteit onderdrukt. Zonisamide heeft ook een modulerend effect op GABA-gemedieerde neuronale remming. Bij voorkeur werkt zonisamide op aanvallen die hun oorsprong hebben in de cortex.3
Kinetiek
Na orale toediening wordt zonisamide bijna volledig geabsorbeerd en wordt de maximale plasmaconcentratie (Cmax) na twee tot vijf uur bereikt. Voedsel heeft geen invloed op de mate van absorptie. De plasma-eiwitbinding bedraagt 40-50%. Zonisamide cumuleert in erytrocyten. Het verdelingsvolume is bij volwassenen ongeveer 1,1-1,7 l/kg lichaamsgewicht. Zonisamide wordt grotendeels gemetaboliseerd door middel van reductieve splitsing van de benzisoxazoolring door CYP3A4 en door N-acetylering. Zonisamide en de gevormde metaboliet kunnen daarnaast worden geglucuronideerd. De metabolieten hebben geen anticonvulsieve activiteit. Steady state wordt binnen dertien dagen bereikt. De farmacokinetiek is nagenoeg lineair over een doseringsbereik van eenmaal daags 100-400 mg. Uitscheiding vindt hoofdzakelijk via de urine plaats, ongeveer 15-30% wordt onveranderd uitgescheiden. De eliminatiehalfwaardetijd is - indien niet gecombineerd met CYP3A4 inductoren - ongeveer 60 uur. De eliminatiehalfwaardetijd uit erytrocyten bedraagt ongeveer 105 uur.3
Klinische studies
De werkzaamheid van zonisamide als add-on-behandeling bij partiële epilepsie is onderzocht in drie 12 weken durende studies4-6 (Schmidt et al. 1993, Faught et al. 2001 en Sackellares et al. 2004) en één tot 24 weken durende studie7 (Brodie et al. 2005). Deze studies werden alle gesponsord door de industrie.
In de onderzoeken met zonisamide wordt de respons gehanteerd als primair eindpunt. Deze is gedefinieerd als de responder ratio: een reductie in aanvalsfrequentie met tenminste 50% ten opzichte van de uitgangswaarde. Als tweede primaire eindpunt wordt gebruik gemaakt van de mediane procentuele reductie in aanvalsfrequentie. Deze eindpunten voldoen aan de richtlijn van de Committee for Proprietary Medicinal Products (CPMP) die bij adjuvantia de voorkeur geeft aan vooraf gedefinieerde responders.8
Over de werkzaamheid van zonisamide in de onderzoeken van Schmidt et al. en Sackellares et al. kon geen uitspraak worden gedaan omdat de onderzoeken van te korte duur waren.9 In beide studies werd de dosis in vier weken opgebouwd, waarna het effect gedurende slechts acht weken werd bestudeerd. Deze periode voldoet niet aan de criteria volgens de richtlijn van de CPMP.8 9
Aan de studie van Schmidt et al. namen 139 patiënten deel.4 De mediane dosering zonisamide bedroeg 400 mg per dag. De responder ratio bedroeg 29,9% in de met zonisamide behandelde groep en 9,4% in de placebogroep (p<0,05). Ten opzichte van placebo was de reductie in aanvalsfrequentie 27,7% (p<0,05). De resultaten van de studie van Sackellares toonden een responder ratio van 30,8% in de 7 mg/kg/dag zonisamidegroep en 13,9% in de placebogroep (p=0,02).6 De aanvalsfrequentie werd in de met zonisamide behandelde groep met 28,9% gereduceerd en nam toe in de placebogroep met 4,7% (p<0,01).
Het onderzoek van Faught et al. werd uitgevoerd in twintig verschillende behandelcentra in de Verenigde Staten.5 Het betrof een dubbelblind, gerandomiseerd, placebo-gecontroleerd onderzoek waaraan 203 refractaire patiënten met partiële epilepsie - al dan niet met secundaire generalisatie - deelnamen. Inclusiecriteria waren tenminste vier aanvallen per maand in de drie maanden voorafgaand aan deelname aan het onderzoek en een standaardbehandeling met één of twee anti-epileptica, waaronder tenminste carbamazepine, natriumvalproaat, fenytoïne, fenobarbital of primidon. De met zonisamide te behandelen patiënten werden in twee groepen ingedeeld, elk met een eigen opbouwschema tot maximaal 400 mg per dag. De placebogroep werd na twaalf weken alsnog behandeld met zonisamide. De follow up na start van de behandeling bedroeg twintig weken. Behandeling met 400 mg zonisamide per dag resulteerde in een responder ratio van 43% ten opzichte van 22% in de placebogroep (p=0,01). Een reductie van 40,5% in aanvalsfrequentie werd waargenomen, ten opzichte van 9% in de groep die placebo kreeg (p<0,001).5
Aan de 24 weken durende multicentrum, dubbelblinde, gerandomiseerde, placebo-gecontroleerde studie van Brodie et al. namen 351 patiënten deel.7 Inclusiecriteria waren tenminste twaalf partiële epilepsieaanvallen en maximaal drie aaneengesloten weken zonder aanval in de periode van twaalf weken tussen de screening voor het onderzoek en de start van de behandeling. De patiënten werden gerandomiseerd in een verhouding 1:1:2:2 voor behandeling met 100, 300, 500 mg zonisamide per dag of placebo. De dosering werd in zes weken opgebouwd. Na deze titratiefase werden de patiënten gedurende achttien weken gevolgd. Het percentage responders bedroeg 52,5% in de 500 mg-, 42,2% in de 300 mg-, 29,6% in de 100 mg zonisamidegroep en 17,9% bij placebo (p<0,001). Een significant verschil in aanvalsreductie ten opzichte van placebo werd aangetoond voor zowel de groep die 500 mg zonisamide per dag kreeg (51,3%, p<0,0001) als de groep van 300 mg per dag (41,8%, p=0,0005), maar kon niet aangetoond worden voor de groep met een dosis van 100 mg per dag.7
In een Cochrane Review werden de gegevens van gerandomiseerde placebo-gecontroleerde onderzoeken naar de effectiviteit van zonisamide gecombineerd.10 Hieruit kwam naar voren dat het gebruik van 300 tot 500 mg zonisamide per dag bij refractaire patiënten met partiële epilepsie resulteerde in een 2 tot 2,4 keer hogere responder ratio ten opzichte van placebo.
Bijwerkingen
Zeer vaak (‰¥1/10) voorkomende bijwerkingen zijn slaperigheid, duizeligheid, ataxie, geheugenverzwakking, anorexia, agitatie, prikkelbaarheid, verwardheid, depressie, dubbelzien en een verlaagde bicarbonaatbloedspiegel.
Vaak (‰¥1/100 - <1/10) voorkomende bijwerkingen zijn kleine bloeduitstortingen, huiduitslag, psychische stoornissen als angst, slapeloosheid en psychotische stoornis, paresthesie, spraakstoornis, tremor, bradyfrenie, concentratiestoornis, nystagmus, maag- en darmklachten, misselijkheid, gewichtsverlies, nefrolithiasis, vermoeidheid, griepachtige verschijnselen en pyrexie.
Soms (‰¥1/1000 - <1/100) worden gemeld pneumonie, urineweginfecties, hypokaliëmie, woede, agressie, zelfmoordgedachten, zelfmoordpoging, convulsie, braken, cholecystitis, cholelithiasis en urinestenen.
Tijdens de behandeling met zonisamide kan ernstige huiduitslag optreden waaronder gevallen van het syndroom van Stevens-Johnson. Bij het optreden van onverklaarbare huiduitslag moet de patiënt nauwlettend worden gecontroleerd en dient overwogen te worden te stoppen met dit middel.
Het molecuul zonisamide bevat een sulfonamidegroep. Bij overgevoeligheid voor sulfonamiden kunnen ernstige bijwerkingen als huiduitslag, allergische reactie en aanzienlijke hematologische stoornissen optreden.3
Interacties
Uit in vitro onderzoeken is gebleken dat zonisamide cytochroom P450-iso-enzymen nagenoeg niet remt. Onderzoek in patiëntenpopulaties heeft aangetoond dat zonisamide geen invloed heeft op de farmacokinetiek van carbamazepine, fenytoïne, lamotrigine en natriumvalproaat. Ook heeft zonisamide geen invloed op serumconcentraties ethinylestradiol en norethisteron. Er zijn onvoldoende gegevens bekend over een mogelijk farmacodynamische interactie tussen koolzuuranhydraseremmers zoals topiramaat en zonisamide. Gecombineerd gebruik wordt daarom afgeraden. Theoretisch is het mogelijk dat zonisamide de farmacokinetiek van middelen die substraat zijn voor P-gp, beïnvloedt. Uit in vitro onderzoek is namelijk gebleken dat zonisamide een zwakke remmer is van P-gp. Voorzichtigheid is geboden bij starten, stoppen of wijzigen van de dosering zonisamide bij patiënten die geneesmiddelen gebruiken die P-gp-substraten zijn zoals digoxine en kinidine. Een verlaging van de dosering van deze middelen kan nodig zijn.
Combinatie van zonisamide met andere middelen die kunnen leiden tot urolithiasis dient te worden vermeden. De bloedspiegels van zonisamide kunnen lager zijn dan verwacht bij gelijktijdig gebruik van krachtige CYP3A4-inductoren als carbamazepine, fenytoïne en rifampicine.3
Contra-indicaties
Het middel is gecontraïndiceerd bij overgevoeligheid voor zonisamide, een van de hulpstoffen of sulfonamiden. Voorzichtigheid is geboden bij verminderde nierfunctie (glomerulaire filtratiesnelheid <50 ml/min) en milde tot matig ernstige leverfunctiestoornis in verband met het ontbreken van voldoende informatie over het gebruik bij deze patiëntengroepen. Het middel dient gestopt te worden bij acuut nier-falen en wordt afgeraden bij ernstige leverfunctiestoornis.3
Zwangerschap en lactatie
Zonisamide dient niet tijdens de zwangerschap gebruikt te worden, tenzij strikt noodzakelijk. Uit experimenteel onderzoek bij dieren is reproductietoxiciteit gebleken. Over het gebruik van zonisamide bij de mens zijn onvoldoende gegevens bekend. Tijdens de behandeling met zonisamide dienen vrouwen in de vruchtbare leeftijd anticonceptie te gebruiken gedurende de behandeling tot een maand na het staken ervan. Vrouwen die anti-epileptica gebruiken en zwanger willen raken dienen specialistisch advies te krijgen om de optimale behandeling te (her)overwegen.
Zonisamide wordt uitgescheiden in de moedermelk. Het geven van borstvoeding wordt daarom afgeraden. In verband met de lange halfwaardetijd van zonisamide mag het geven van borstvoeding pas worden hervat nadat een maand verstreken is na het stoppen van de medicatie.3
Voorlichting aan de patiënt
Zonisamide moet in zijn geheel met water worden ingenomen, al dan niet in combinatie met voedsel. De capsule kan in een dosering van een- of tweemaal daags worden voorgeschreven. Indien een dosering wordt vergeten kan deze worden overgeslagen. Het innemen van een dubbele dosis om de vergeten dosering in te halen wordt afgeraden. In verband met het risico op bijwerkingen als slaperigheid en concentratieproblemen is - vooral in het begin van de behandeling of na dosisverhoging - voorzichtigheid geboden tijdens autorijden en het bedienen van machines.3
Handelspreparaat, dosering en prijs
Zonisamide wordt door Eisai op de markt gebracht onder de naam (Zonegran®) Het is beschikbaar in capsules van 25, 50 en 100 mg en dient te worden toegevoegd aan bestaande therapie met anti-epileptica. De aanbevolen startdosis is tweemaal daags 25 mg gedurende een week, gevolgd door tweemaal daags 50 mg gedurende een week. Daarna kan de dosering in stappen van maximaal 100 mg per week verder worden verhoogd op basis van het klinische effect tot maximaal 500 mg per dag. De meeste patiënten die tevens CYP3A4-inducerende stoffen gebruiken worden behandeld met doses van 300 tot 500 mg per dag. Vooral patiënten die geen CYP3A4-inductor gebruiken, reageren meestal al op een lagere dosis. Nadat de patiënt op een vaste dosering is ingesteld kan zonisamide ook eenmaal daags worden toegediend. Voor patiënten met nier- of leverfunctiestoornis en patiënten die geen CYP3A4-inductoren ontvangen wordt het gebruik van tweewekelijkse tussenpozen in de titratiefase aanbevolen.3
Er is weinig bekend over de behandeling van ouderen en van patiënten met een laag lichaamsgewicht (<40 kg). Voorzichtigheid bij deze patiëntengroep is daarom geboden. De veiligheid en werkzaamheid bij kinderen en adolescenten jonger dan achttien jaar is onvoldoende aangetoond en wordt daarom afgeraden.3
Om de kans op aanvallen bij het stoppen te voorkomen, moet zonisamide geleidelijk afgebouwd te worden in stappen van 100 mg per week.3
Zonisamide wordt geheel vergoed door de ziektekostenverzekeraar.
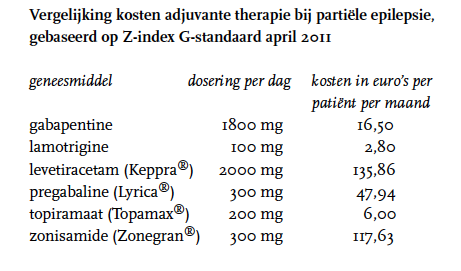
Conclusie en plaatsbepaling
Onderzoek toont aan dat zonisamide de aanvalsfrequentie bij patiënten met partiële epilepsie significant vermindert ten opzichte van placebo. In de gerandomiseerde, gecontroleerde onderzoeken werden de patiënten 12 tot 24 weken behandeld. Conclusies over effectiviteit op de lange termijn kunnen daarom niet worden getrokken. Het middel is al vanaf 1989 op de markt in Japan en is sinds 2000 geregistreerd in de Verenigde Staten.3 Hierdoor is er wel ruime ervaring met het middel opgedaan, maar helaas nog steeds niet bij alle patiëntengroepen. Ook is er geen direct vergelijkend onderzoek naar de effectiviteit van zonisamide ten opzichte van andere adjuvante anti-epileptica, waardoor er geen uitspraak kan worden gedaan over de voorkeur voor zonisamide of andere anti-epileptica bij de add-on-behandeling van partiële epilepsie. Op basis van meta-analyses lijkt de werkzaamheid overeen te komen met die van andere adjuvante anti-epileptica.9 De meest gerapporteerde bijwerkingen waren ataxie, slaperigheid, agitatie en anorexia. Ook deze lijken over het algemeen weinig te verschillen met andere anti-epileptica.
Argumenten die voor zonisamide spreken zijn de mogelijkheid om eenmaal daags te doseren, het nagenoeg niet optreden van interacties op CYP450-niveau en dat tevens is aangetoond dat zonisamide de werking van orale anticonceptiva niet vermindert. Tegenargumenten zijn de relatief hoge kosten, het ontbreken van direct vergelijkend onderzoek met andere add-on-behandelingen, het ontbreken van gegevens over de veiligheid en effectiviteit op de lange termijn en over de werkzaamheid en veiligheid bij kinderen, ouderen en nierpatiënten. Deze nadelen leiden ertoe dat de plaats van zonisamide bij de adjuvante behandeling van partiële epilepsie uiterst beperkt is.
Literatuur
1 Werkgroep richtlijnen epilepsie. Richtlijnen diagnostiek en behandeling van epilepsie. Tweede herziene versie. Utrecht. Nederlandse Vereniging voor Neurologie, 2006.
2 KNMP Kennisbank (geraadpleegd 01-04-2011).
3 Anoniem. Samenvatting van de productkenmerken Zonegran. www.emea.europa.eu (geraadpleegd 28-03-2011).
4 Schmidt D, Jacob R, Loiseau P et al. Zonisamide for add-on treatment of refractory partial epilepsy: a European double blind trial. Epilepsy Research 1993;15:67-73.
5 Faught E, Ayala R, Montouris G et al. Randomized controlled trial of zonisamide for the treatment of refractory partial-onset seizures. Neurology 2001;57:1774-1779.
6 Sackellares JC, Ramsay RE, Browne TR et al. Randomized controlled clinical trial of zonisamide as adjunctive treatment for refractory seizures. Epilepsia 2004;45:610-617.
7 Brodie MJ, Duncan R, Vespignani H et al. Dose-dependent safety and efficacy of zonisamide: a randomized, double-blind, placebo-controlled study in patients with refractory partial seizures. Epilepsia 2005;46:31-41.
8 EMEA. Note for Guidance on Clinical Investigation of Medical Products in the Treatment of Epileptic Disorders (CMPM adopted November 2000). EMEA. London, 2000. CPMP/EWP/566/98 rev 1.
9 CFH-rapport 07/03. Zonisamide (Zonegran). 2007. www.cvz.nl (geraadpleegd 03-04-2011).
10 Chadwick DW, Marson AG. Zonisamide add-on for drug-resistant partial epilepsy. Cochrane Database Syst Rev 2005;19(4):CD001416.