Samenvatting
Retigabine (Trobalt®) is geregistreerd voor de behandeling van patiënten met een therapieresistente vorm van partiële epilepsie. Retigabine werkt primair via het openen van neuronale kaliumkanalen. Door opening van deze kanalen wordt de rustmembraanpotentiaal gestabiliseerd en wordt de subdrempelwaarde van de elektrische activatie van neuronen gecontroleerd. Twee fase 3 klinische studies hebben aangetoond dat retigabine effectiever is dan placebo in doseringen van 900 en 1200 mg per dag. Direct vergelijkende onderzoeken met conventionele therapieën ontbreken echter. Tevens zijn de studies uitgevoerd bij patiënten zonder relevante comorbiditeit, waardoor gegevens over het gebruik van retigabine in een representatieve patiëntengroep vooralsnog niet voorhanden zijn. Vooral het QT-verlengende effect, alsmede een verstoorde urinelozing, zijn bijwerkingen waarvan de klinische relevantie verder moet worden onderzocht voordat retigabine een vaste plaats op de markt kan veroveren als add-on therapie.
A.H.J. Janse en K.H. van Rooijen-Schuurman, onder medeverantwoordelijkheid van de redactie
Abstract
Reitgabine (Trobalt®) is approved for the treatment of treatment-resistant partial epilepsy. It primarily acts by opening neuronal potassium channels, thereby stabilizing the membrane potential and regulating the subthreshold electrical activity of neurons. Two phase III clinical trials have shown retigabine (900 and 1200 mg/day) to be more effective than placebo, but the drug has not been compared with conventional treatments. Moreover, the studies recruited patients without relevant comorbidity, so for the moment there are no data for a representative patient sample. The clinical relevance of the side effects of QT lengthening and urinary hesitation needs to be investigated before retigabine can become established as add-on therapy.
Pharm Sel 2011;27:75-79.
Inleiding
Epilepsie is een chronische neurologische aandoening, gekenmerkt door het optreden van epileptische aanvallen die plotseling optreden en van voorbijgaande aard zijn. Een epileptische aanval wordt meestal veroorzaakt door kortdurende, overmatige en synchrone ontladingen van een groep neuronen in de cerebrale cortex. De diagnose wordt gesteld wanneer de patiënt tenminste één laat-symptomatische - veroorzaakt door een langer bestaande onderliggende structurele hersenafwijking - of twee niet-geprovoceerde aanvallen heeft gehad. In Nederland worden meer dan 80.000 mensen behandeld voor epilepsie. Jaarlijks worden er tot 8.100 nieuwe ziektegevallen gediagnosticeerd. De incidentie is relatief hoog bij kinderen, neemt daarna af en stijgt weer op hogere leeftijd. Epileptische aanvallen kunnen op verschillende wijze tot uiting komen. Partiële aanvallen treden op bij zeventig procent van de epilepsiepatiënten. Ze ontstaan door plaatselijke elektrische ontladingen. De symptomen die optreden zijn afhankelijk van het hersendeel, waardoor er sprake kan zijn van motorische verschijnselen (onder andere trekkingen van een arm of been, smakkende mondbewegingen), waarnemingsstoornissen, psychische en autonome verschijnselen. Er kan onderscheid worden gemaakt tussen de eenvoudige en complexe partiële vorm. Het verschil is dat bij de eenvoudige vorm géén en bij de complexe vorm wél bewustzijnsveranderingen optreden. Een partiële aanval kan overgaan in een secundair gegeneraliseerde aanval. Hierbij worden plotseling alle hersencellen door elektrische ontladingen geprikkeld. Twee belangrijke vormen van gegeneraliseerde epilepsie zijn absences en de tonisch-clonische aanvallen. Daarnaast zijn er ook niet-classificeerbare vormen van epilepsie.
De Nederlandse Vereniging voor Neurologie heeft een richtlijn opgesteld voor de behandeling van epilepsie. Medicamenteuze behandeling wordt doorgaans gestart bij twee of meer aanvallen binnen één jaar of na een status epilepticus. De keuze van het anti-epilepticum wordt bepaald door het epilepsiesyndroom, het type aanvallen, de te verwachten effectiviteit en bijwerkingen, de behoeften van de individuele patiënt en factoren als comorbiditeit en comedicatie. De middelen van eerste keus bij partiële aanvallen zijn carbamazepine, oxcarbazepine, natriumvalproaat en lamotrigine. Middelen van tweede keus zijn clobazam, fenytoïne, gabapentine, levetiracetam en topiramaat. Bij onvoldoende effectiviteit van het eerstekeusmiddel verdient het de voorkeur om een alternatief anti-epilepticum te starten zonder het eerste middel uit te sluipen (add-on therapie). Idealiter wordt bij een gunstig effect van het tweede middel, het eerste middel langzaam afgebouwd vanwege het risico op onttrekkingsinsulten of status epilepticus. Als het tweede middel niet effectief is moet dit w orden uitgeslopen en vervangen door een tweede add-on anti-epilepticum. Deze werkwijze wordt steeds herhaald totdat de optimale therapie is bereikt. Na twee tot drie pogingen tot monotherapie, gaat men over op combinatietherapie. Na drie tot vier mislukte pogingen wordt de patiënt gediagnostiseerd met therapieresistente epilepsie. Ongeveer 25 tot 30 procent van de patiënten met partiële epilepsie vallen in deze categorie.1-4
In Europa is retigabine door GlaxoSmithKline onder de merknaam Trobalt® op de markt gebracht. Retigabine is geregistreerd als add-on therapie bij patiënten met therapieresistente partiële epilepsie. In dit artikel zullen de effectiviteit en veiligheid van retigabine beoordeeld worden.
Farmacologie
Dynamiek
Kaliumkanalen behoren tot de spanningsafhankelijke ionkanalen in neuronale cellen. Ze zijn belangrijke indicatoren van neuronale activiteit. Kaliumkanalen zorgen ervoor dat de membraanpotentiaal na een actiepotentiaal weer terugkeert naar de rustpotentiaal en houden deze stabiel. Mutaties in de kaliumkanalen (KCNQ2 en KCNQ3: subfamilies van kaliumkanalen die vooral in de hersenen aanwezig zijn5) liggen onder andere ten grondslag aan menselijke erfelijke afwijkingen die betrokken zijn bij het ontstaan van epilepsie. Retigabine werkt primair via het openen van deze neuronale kaliumkanalen. Door opening van deze kaliumkanalen wordt de rustmembraanpotentiaal gestabiliseerd en wordt de subdrempelwaarde van de elektrische activering van neuronen gecontroleerd. Hierdoor wordt het ontstaan van epileptiforme actiepotentiaalactiviteit voorkomen. Het werkingsmechanisme van retigabine op de kaliumkanalen is goed gedocumenteerd. Andere mechanismen waardoor retigabine een anti-epileptisch effect kan bewerkstellingen, zijn niet geheel bekend.6
Kinetiek
Retigabine wordt relatief snel geabsorbeerd. Na orale inname wordt na 0,5 tot 2 uur de tmax bereikt. Voedsel vertraagt de absorptiesnelheid maar heeft geen invloed op de mate ervan. De orale biologische beschikbaarheid is 60%. Retigabine wordt voor ongeveer 80% aan plasma-eiwitten gebonden. Het wordt grotendeels door glucuronidering omgezet in inactieve N-glucuroniden. Tevens wordt retigabine gemetaboliseerd tot een N-acetylmetaboliet (NAMR) die vervolgens ook wordt geglucuronideerd. NAMR heeft een anti-epileptische werking. Er is tot nog toe geen bewijs gevonden voor oxidatief metabolisme in de lever door cytochroom P450-enzymen. Retigabine wordt voornamelijk hepatisch en renaal geklaard. Van de dosis wordt 84% teruggevonden in de urine en slechts 14% wordt uitgescheiden met de feces. De plasmahalfwaardetijd van retigabine is 6 tot 10 uur. Retigabine vertoont een lineaire farmacokinetiek, zonder onverwachte stapeling na herhaalde toediening.
De AUC neemt met ongeveer 30% toe bij een creatinineklaring van 50 tot 80 ml/min en met ongeveer 100% bij een creatinineklaring van <50 ml/min. Om deze reden is een dosisaanpassing gewenst bij patiënten met een creatinineklaring van <50 ml/min. Of retigabine door hemodialyse geklaard kan worden is tot op heden onbekend.6
Klinische studies
Er zijn drie multicenter, gerandomiseerde, dubbelblinde, placebo-gecontroleerde onderzoeken bij in totaal 1239 volwassen patiënten uitgevoerd om de werkzaamheid van retigabine als adjuvante behandeling van partiële aanvallen, met of zonder secundaire generalisatie, te beoordelen. Alle patiënten die werden geïncludeerd moesten partiële aanvallen hebben gehad die niet voldoende onder controle konden worden gebracht met één tot drie gelijktijdig gebruikte anti-epileptica. Meer dan 75% van alle patiënten gebruikte tegelijkertijd twee of meer anti-epileptica. Patiënten werden ingesteld op placebo of retigabine in doseringen van 600, 900 of 1200 mg/dag. Tijdens een acht weken durende baseline fase moesten de patiënten vier of meer partiële aanvallen per 28 dagen hebben gehad. Ze mochten gedurende 21 dagen of meer niet aanvalsvrij zijn. Patiënten werden eveneens geëxcludeerd indien zij vrouwen waren met een risico op zwangerschap, een slechte nierfunctie hadden, czs-gerelateerde progressieve ziektebeelden anders dan epilepsie hadden en indien zij QTc-verlengende geneesmiddelen gebruikten dan wel aandoeningen hadden die de CTc verlengde. De duur van de onderhoudsfase was acht of twaalf weken.6-9 De primaire eindpunten waren het percentage verandering in de totale partiële aanvalsfrequentie van baseline tot de dubbelblinde fase gedurende 28 dagen, alsmede de responsratio - het percentage patiënten met een ‰¥50% reductie in de totale partiële aanvalsfrequentie, gedurende 28 dagen - van baseline tot de onderhoudsfase (RESTORE I en II).
In de RESTORE I, een multicenter, gerandomiseerde, dubbelblinde, placebo-gecontroleerde fase 3-studie werd de werkzaamheid en veiligheid van retigabine (1200 mg/dag) als add-on therapie bij patiënten met therapieresistente partiële epilepsie onderzocht. De primaire eindepunten waren de daling van het aantal partiële aanvallen over de achttien weekse studieperiode en de responsratio (gedefinieerd als het percentage patiënten dat meer dan 50% reductie laat zien in het aantal partiële aanvallen). Patiënten in de retigabinegroep werden vanuit 300 mg/dag naar 1200 mg/dag getitreerd in stappen van 150 mg/dag per week. Vervolgens werden ze gedurende twaalf weken gevolgd tijdens de onderhoudsfase. Retigabine werd in drie gelijke doses van 400 mg, verdeeld over de dag, oraal toegediend. Van de 442 gescreende patiënten, werden er 306 dubbelblind gerandomiseerd naar het gebruik van retigabine (1200 mg/dag) (n=153) en placebo (n=152). In de retigabinegroep hebben 97 van de 153 patiënten de studie volledig afgerond. In deze groep is 26,8% gestopt vanwege het ontstaan van bijwerkingen; voornamelijk duizeligheid, verwarring en vermoeidheid. In de placebogroep hadden 127 van de 152 patiënten de studieperiode volledig afgerond, waarbij 8,6% was gestaakt wegens het optreden van bijwerkingen. Het gemiddeld aantal partiële aanvallen over de gehele studieperiode was gedaald met 44,3% in de retigabinegroep versus 17,5% in de placebogroep (p<0,001). Responsratio's van de retigabinegroep versus placebo waren 44,4% versus 17,8% (p<0,001). Het percentage patiënten dat zich terugtrok uit de studie vanwege bijwerkingen was 26,8 in de retigabinegroep versus 8,6 in de placebogroep. De meest voorkomende bijwerkingen waren duizeligheid, vermoeidheid, verwarring, dysarthrie, urineweginfecties, ataxie en wazig zien.8
In de RESTORE II, multicenter, gerandomiseerde, dubbelblinde, placebo-gecontroleerde fase 3-studie werd de veiligheid en effectiviteit van retigabine 600 en 900 mg/dag beoordeeld en vergeleken met placebo. De studie bestond uit drie fasen: een prospectieve baselinefase van acht weken, een vier weken durende titratiefase en een onderhoudsfase van twaalf weken. Tijdens de eerste fase werden patiënten getitreerd vanaf 300 naar 600 en 900 mg/dag in stappen van 150 mg/dag per week tot de onderhoudsdosering van 600 dan wel 900 mg/dag werd bereikt. De dagelijkse dosis werd verdeeld over drie gelijke doseringen per dag. Na titratie werden patiënten gemonitord gedurende de twaalf weekse onderhoudsfase van de studie. Van de 538 patiënten die oorspronkelijk werden geïncludeerd bereikten 471 de onderhoudsfase. Patiënten werden gerandomiseerd over de behandelgroepen placebo (n=164), retigabine 600 mg/dag (n=158) en retigabine 900 mg/dag (n=149). De totale partiële aanvalsfrequentie verminderde meer bij beide retigabinegroepen (600 mg/dag 27,9%, p<0,007; 900 mg/dag 39,9%, p<0,001) in vergelijking met placebo (15,9%). Responsratio's waren hoger in de retigabinegroepen (600 mg/dag 38,6%, p<0,001; 900 mg/dag 47,0%, p<0,001 in vergelijking met placebo 18,9%). Het aantal patiënten dat zich terugtrok uit de studie vanwege bijwerkingen was hoger bij beide retigabinegroepen (600 mg/dag 17% en 900 mg/dag 26%) in vergelijking met placebo (8%). De meest gerapporteerde bijwerkingen waren bij respectievelijk placebo, retigabine 600 mg/dag en 900 mg/dag: duizeligheid (7, 17, en 26%), somnolentie (10, 14 en 26%) en vermoeidheid (3, 15 en 17%).9
In een fase 2, multicenter, gerandomiseerdem dubbelblinde, placebo-gecontroleerde studie werden de veiligheid en effectiviteit van retigabine 600, 900 en 1200 mg/dag versus placebo onderzocht. Het primaire eindpunt was de procentuele daling van het maandelijks aantal aanvallen gedurende de zestien weken behandelingsfase van de studie. Secundair eindpunt was de responsratio tijdens de zestien weken behandeling. De studie bestond uit een acht weekse baselinefase waarin de initiële selectie van patiënten plaatsvond, een acht weekse titratiefase waarin de verschillende retigabinegroepen werden getitreerd tot de onderhoudsdosering van 600, 900 en 1200 mg/dag en een acht weekse onderhoudsfase. Van de 537 patiënten werden er 399 gerandomiseerd over de behandelgroepen placebo (n=96), retigabine 600 mg/dag (n=99), retigabine 900 mg/dag (n=95) en retigabine 1200 mg/dag (n=106).
Het aantal partiële aanvallen per maand was gedaald met 23,4% (p<0,001), 29,3% (p=0,0378) en 35,2% (p=0,0024), voor respectievelijk retigabine 600, 900 en 1200 mg/dag ten opzichte van placebo (13,1%). De responsratio's voor de retigabinegroepen waren 23, 32 en 33% voor respectievelijk retigabine 600, 900 en 1200 mg/dag versus 16% voor placebo (p=0,016). Bij vergelijking van het primaire eindpunt van tussen placebo en retigabine 600 mg/dag, lijkt er geen significant verschil te zijn tussen deze twee behandelgroepen. Aan czs gerelateerde bijwerkingen werden vaker waargenomen bij retigabine (46% bij 600; 60% bij 900 en 72% bij 1200 mg retigabine/dag) in vergelijking met placebo (32%). Deze bijwerkingen traden vooral op tijdens de titratiefase en lijken dosis gerelateerd te zijn. Ze betroffen in de meeste gevallen vermoeidheid, duizeligheid, verwarring, spraakgebrek en ataxie. Er hadden zich 79 patiënten teruggetrokken uit de studie wegens het ontstaan van bijwerkingen, waarvan respectievelijk 17, 19, 31 en 12 patiënten uit de retigabinegroepen 600, 900, 1200 mg/dag en de placebogroep.7
Bijwerkingen
Duizeligheid, somnolentie en vermoeidheid traden in 10% van de gevallen op. In 1% van de gevallen was sprake van amnesie, vertigo, evenwichtsstoornis, tremor, wazig gezichtsvermogen en gewichtstoename. Bij patiënten ouder dan 65 jaar traden deze bijwerkingen vaak sneller op vanwege de grotere kwetsbaarheid voor aandoeningen van het centraal zenuwstelsel. Bij 9% van de patiënten werd een verwarde toestand gezien en bij 2% kwamen hallucinaties voor. De meeste bijwerkingen traden op in de eerste acht behandelweken tijdens de titratieperiode. Alleen bij het optreden van verwarring werd een duidelijke dosisresponsrelatie waargenomen. Een zeldzame maar unieke bijwerking is het optreden van een gestoorde urinelozing.6
Interacties
Uit in vitro onderzoek met humane levermicrosomen bleek dat retigabine weinig of geen remmend vermogen heeft op CYP1A2, -2A6, -2C8, -2C9, -2C19, -2D6, -2E1 en -3A4/5.
Fenytoïne kan de biologische beschikbaarheid van retigabine verlagen met 35%. Carbamazepine verlaagt de biologische beschikbaarheid met 33%. De N-acetylmetaboliet van retigabine (NAMR) remt het P-glycoproteïne gemedieerde transport van digoxine en kan daardoor de serumconcentratie van digoxine verhogen. Retigabine kan de werkingsduur van natriumthiopental verlengen. Tijdens het gebruik van retigabine wordt de inname van alcohol ontraden in verband met het versterken van de duizeligheid en het wazig zien dat ontstaat. Retigabine heeft geen klinisch significante invloed op de plasmadalconcentraties van veelgebruikte anti-epileptica zoals carbamazepine, gabapentine, lamotrigine, levetiracetam, pregabaline, valproaat en topiramaat.6
Contra-indicaties
Het gebruik van retigabine is gecontraïndiceerd bij een verminderde nierfunctie (creatinineklaring <10 ml/min) omdat het voornamelijk renaal geklaard wordt. Retigabine heeft een QT-verlengend effect, waardoor voorzichtigheid geboden is met andere middelen die het QT-interval verlengen. Voorzichtigheid is geboden met het voorschrijven aan patiënten die bekend zijn met hartfalen, ventriculaire hypertrofie, hypokaliëmie en patiënten ouder dan 65 jaar.
Retigabine kan bij mensen met mentale stoornissen psychosen en hallucinaties versterken. Deze effecten treden meestal op in de eerste acht weken van behandeling. Gebruik bij patiënten met suïcidale neigingen kan de drempel naar zelfdoding verlagen.
Zwangerschap en borstvoeding
Het gebruik van retigabine wordt wegens het ontbreken van gegevens van gebruik bij zwangere vrouwen niet aanbevolen tijdens de zwangerschap en bij vrouwen in de vruchtbare leeftijd die geen anticonceptie gebruiken. Het is niet bekend of retigabine bij de mens in de moedermelk wordt uitgescheiden. Het voordeel van een behandeling moet worden afgewogen tegen het voordeel van borstvoeding voor het kind. Borstvoeding wordt, wegens het ontbreken van voldoende gegevens, ontraden bij het gebruik van retigabine.6
Handelspreparaat, dosering en prijs
Retigabine wordt door GlaxoSmithKline op de markt gebracht onder de naam Trobalt®.
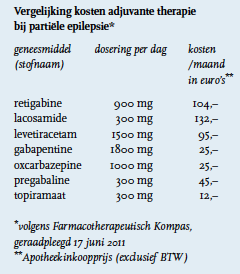
De aanbevolen dagelijkse dosering ligt op 900 mg per dag in drie gelijke doses verdeeld over de dag. De maximumdosis is 1200 mg per dag. De kosten liggen op 103,50 euro per maand (afgerond 104 euro: zie tabel) en is daarmee veel duurder dan veel van de conventioneel gebruikte anti-epileptica zoals levetiracetam, gabapentine en pregabaline.10
Vergelijking kosten adjuvante therapie bij partiële epilepsie*
Conclusie
Retigabine werkt primair via het openen van de neuronale kaliumkanalen. Het stabiliseert daarmee de rustmembraanpotentiaal en controleert de subdrempelwaarde van de elektrische activatie van neuronen, waardoor het ontstaan van epileptiforme actiepotentiaalactiviteit wordt voorkomen. Hiermee wordt een nieuw target aangegrepen bij de behandeling van partiële epilepsie. Uit twee fase 3- en één fase 2-studies met retigabine versus placebo blijkt dat retigabine het meest effectief is in een dosering van 900 of 1200 mg per dag. Aangezien de behandelperiode tijdens de onderzoeken slechts een onderhoudsfase van acht tot twaalf weken bestrijkt, zijn er nog geen conclusies mogelijk met betrekking tot de veiligheid en effectiviteit op lange termijn. De RESTORE I- en II-studies zijn verlengd tot 365 dagen, maar de resultaten van deze verlenging zijn tot op heden nog niet bekend. Op interactieniveau lijkt retigabine een interessante aanwinst, omdat het middel niet via het cytochroom P450-enzymsysteem wordt gemetaboliseerd. Retigabine wordt grotendeels renaal geklaard, waardoor toepassing bij een verminderde nierfunctie (creatinineklaring <50 ml/min) vooralsnog niet is aan te raden. Retigabine heeft een QT-verlengend effect, waardoor er mogelijk een risico is bij de toepassing naast andere QT-verlengende geneesmiddelen. De fabrikant adviseert om voorafgaand aan toepassing van retigabine een ECG te laten maken om QT-verlenging uit te sluiten. Veel voorkomende bijwerkingen zijn somnolentie, duizeligheid en vermoeidheid. Deze lijken vooral voor te komen bij het optitreren tot de onderhoudsdosering. Bijwerkingen zouden mogelijk verminderd kunnen worden door per patiënt een titratieschema te bepalen dat gunstiger is en minder rigide dan de schema's die tijdens de onderzoeken zijn toegepast. Een bemoeilijkte urinelozing werd slechts bij enkele patiënten waargenomen, maar zal verder moeten worden onderzocht om de ernst van dit effect op de lange termijn te kunnen beoordelen.
Retigabine is op korte termijn bewezen effectief bij de behandeling van patiënten met therapieresistente partiële epilepsie en kan hierbij mogelijk een aanwinst worden.
Met conventionele anti-epileptica is echter meer ervaring opgedaan in de klinische praktijk. Helaas ontbreken direct vergelijkende onderzoeken waarbij retigabine als add-on therapie met andere middelen - zoals levetiracetam, topiramaat en gabapentine - wordt vergeleken. De studies zijn uitgevoerd bij patiënten zonder relevante comorbiditeit waardoor gegevens over het gebruik van in een representatieve patiëntengroep vooralsnog ontbreken. Derhalve heeft retigabine - op dit moment in Europa geregistreerd onder de merknaam Trobalt® - nog geen plaats als standaard add-on bij patiënten met partiële epilepsie.
Literatuur
1 Werkgroep richtlijnen epilepsie. Richtlijnen, diagnostiek en behandeling van epilepsie. Tweede herziene versie, Utrecht, Nederlandse vereniging voor Neurologie, 2006.
2 http://kennisbank.knmp.nl
3 Czuczwar SJ, Patsalos PN. The new generation of GABA enhancers. Potential in the treatment of epilepsy. CNS Drugs 2001;15:339-350.
4 Geleedst-de Vooght MMM, Ensing HT. Pharm Sel 2011(7);27:38-41.
5 Brown DA, Passmore GM. Neural KCNQ (Kv7) channels. Brit J Pharmacol 2009;156:1185-1195.
6 http://www.emea.europa.eu: SmPC Trobalt®. Geraadpleegd op 28 juli 2011.
7 Porter RJ, Partiot A, Sachdeo R et al. Randomized, multicentre, dose-ranging trial of retigabine for partial-onset seizures. Neurology 2007;68:1197-1204.
8 French JA, Abou Khalil BW, Leroy RF et al. Randomized, double-blind, placebo-controlled trial of retigabine in partial epilepsy, Neurology 2011;76:1555-1563.
9 Brodie MJ, Lerche H, Gil-Nagel A et al. Efficacy and safety of adjunctive ezogabine (retigabine) in refractory partial epilepsy. Neurology 2010;75:1817-1824.
10 http://www.fk.cvz.nl