Samenvatting
De P2Y12-receptor is het aangrijpingspunt van een aantal nieuwe middelen die al gebruikt worden of gebruikt kunnen gaan worden bij patiënten met acuut coronair syndroom. Deze receptor speelt een centrale rol in de versterking van de trombocytenactivatie na binding met adenosinedifosfaat. Twee verschillende groepen geneesmiddelen grijpen aan op de P2Y12-receptor: de actieve metabolieten van clopidogrel en prasugrel / deze werken via een irreversibele binding aan de receptor /, en de reversibel-bindende remmers waaronder ticagrelor (Possia®). Op de gezamenlijke primaire eindpunten / cardiovasculaire dood, myocardinfarct en beroerte / liet ticagrelor een relatief lager risico zien van 16 procent en een absolute risicoreductie van 1,9 procent over de twaalf studiemaanden vergeleken met clopidogrel. Ook is de overall mortaliteit voor de ticagrelorgroep significant lager dan voor de clopidogrelgroep. Bijwerkingen die opvielen waren dyspnoe, aritmisch effect op het hart, een verhoogd urinezuur en hoger serumcreatinine. Ticagrelor heeft een aantal goede eigenschappen om een aanvulling te zijn op het huidige arsenaal, maar vanwege het veelal langdurige gebruik van deze middelen dient het veiligheidsprofiel nog beter in kaart te worden gebracht.
H.T. Ensing en A.H.J. Janse, onder medeverantwoordelijkheid van de redactie
Abstract
The P2Y12 receptor is the site of action of a number of new drugs for the treatment of acute coronary syndrome. The receptor plays a central role in reinforcing the activity of thrombocytes following the binding of adenosine phosphate. Two different groups of drugs act at the P2Y12 receptor: the active metabolites of clopidogrel and prasugrel, which bind irreversibly to the receptor, and reversible inhibitors such as ticagrelor (Possia®). Compared with clopidogrel, ticagrelor results in a relatively lower risk (16%) of the combined primary endpoint (cardiovascular death, myocardial infarct, and stroke) and an absolute reduction of 1.9%, calculated over twelve studies. Overall mortality was also significantly lower in the ticagrelor group than in the clopidogrel group. Side effects were dyspnoea, arrhythmia, and increased levels of uric acid and serum creatinine. Ticagrelor has a number of good properties that make it an addition to the existing therapeutic arsenal, but its safety profile should be investigated further because these types of drug are often used long term.
Pharm Sel 2011;27:51-55.
Inleiding
Om te komen tot de huidige trombocytenaggregatieremmers is een lange weg afgelegd. Wat 2000 jaar voor Christus bij de Assyriërs begon met de toepassing van wilgenbladeren op pijnlijke gewrichten resulteerde uiteindelijk in een optimale dosering van 80 mg acetylsalicylzuur (ASA) en de veelal duale therapie als secundaire profylaxe bij patiënten met acuut coronair syndroom.
Naast de bewezen effectiviteit van acetylsalicylzuur is steeds verder gezocht naar nog meer aangrijpingspunten in de remming van de trombocytenaggregatie. Het bijzondere van de activatie van de trombocyt is dat deze na endotheelschade zeer snel is, maar wel zó gecontroleerd dat het risico op vasculaire occlusie minimaal blijft. Inmiddels zijn veel oppervlaktereceptoren op de trombocyten opgehelderd die de acties van zowel oplosbare moleculen als endotheelgebonden componenten van de vaatwanden mediëren in de richting van trombocytenactivatie (zie figuur). Mechanismen van trombocytenactivatie en het aangrijpingspunt van verschillende trombocytenaggregatieremmers (bron: Thrombosis and Haemostasis Supplement 1/2011, zie ref. nr. 1)
Het aangrijpingspunt van een aantal nieuwe middelen, die al gebruikt worden of gebruikt kunnen gaan worden, is de P2Y12-receptor. Deze receptor speelt een centrale rol in de versterking van de trombocytenactivatie na binding met adenosinedifosfaat (ADP). Activatie van de trombocyt, door verschillende stimuli, leidt tot het vrijkomen van dense granules, wat gepaard gaat met de vrijgifte van ADP uit deze granules. ADP bindt aan de P2Y12-receptor en stimuleert tot het opnieuw vrijmaken van dense granules en zorgt hiermee voor een potentiëring van de trombocytenactivatie. Door deze cyclus te onderbreken via blokkade van de P2Y12-receptor zal dit proces gestopt kunnen worden. Dit geeft aan dat deze receptor een belangrijk aangrijpingspunt is in het remmen van de trombocytenactivatie en het voorkomen van arteriële trombose.1 Twee verschillende groepen geneesmiddelen grijpen aan op de P2Y12-receptor: de actieve metabolieten van clopidogrel en prasugrel / deze werken via een irreversibele binding aan de receptor / en de reversibel-bindende remmers. Onder de laatste groep valt de in dit artikel beschreven ticagrelor (Possia®). Ticagrelor hoeft niet eerst te worden omgezet naar een actieve metaboliet, maar bindt direct en reversibel aan de P2Y12-receptor. Dit artikel beschrijft de belangrijkste studieresultaten, vooral in vergelijking met clopidogrel en probeert een plaats te vinden voor ticagrelor in de toepassing bij patiënten met acuut coronair syndroom.
Farmacologie
Dynamiek
Ticagrelor behoort tot de klasse van cyclopentyltriazolopyrimidines (CPTP€™s). Ticagrelor en de voornaamste actieve metaboliet AR-C124910XX zijn potente antagonisten van de P2Y12-receptor op de trombocyt. Ze binden aan een goed gedefinieerde plek op deze receptoren en voorkomen zo dat adenosinedifosfaat de P2Y12-pathway / en hiermee amplificatie van de trombocytenactivatie / kan activeren. Deze binding is niet-competitief en er treedt geen inhibitie van ADP-binding aan de P2Y12-receptoren op. Het antagonisme resulteert uiteindelijk in een reversibele en concentratie-afhankelijke remming van ADP-geïnduceerde trombocytenaggregatie. Op verschillende plaatsen in het lichaam komt de P2Y12-receptor voor, onder andere in de hersenen, microglia, gladde spiercellen van het endotheel en lymofocyten. Gebaseerd op de klinische ervaringen met ticagrelor en andere P2Y12-receptorantagonisten die al langer op de markt zijn, is geen relevantie aangetoond van de interactie met de niet-trombocyten P2Y12-receptoren.1 2 Kinetiek De biologische beschikbaarheid van ticagrelor is 35% en de Cmax ongeveer 1,5 uur. Ticagrelor heeft een actieve metaboliet genaamd AR-C124910XX, deze bereikt de Cmax na ongeveer 2,5 uur. Inname van vetrijke maaltijden zorgden niet voor een klinisch relevant verschil in werkzaamheid danwel toxiciteit. Ticagrelor en haar actieve metaboliet zijn vrijwel volledig plasma-eiwitgebonden (>99%) met een verdelingsvolume van 87,5 liter. Het metabolisme naar de actieve metaboliet vindt voornamelijk plaats door CYP3A4 en -3A5. De blootstelling aan de actieve metaboliet is ongeveer 30 tot 40% van de waarde van ticagrelor. Beide zijn ook substraat voor P-glycoproteïne (P-gp) en remmers van P-gp-gemedieerd transport van digoxine. De belangrijkste excretieroute van ticagrelor en haar metabolieten is waarschijnlijk via de gal. Voor minder dan 1% worden deze stoffen via de urine uitgescheiden. Het metabolietpatroon van de gal verschilt van het patroon in de feces. Dit suggereert een metabolisme terug naar ticagrelor in de darmen. De eliminatiehalfwaardetijd van ticagrelor is ongeveer 7 uur en ongeveer 8,5 uur voor de actieve metaboliet. De werking zal na ongeveer 0,5 uur intreden, met het maximum op 2 tot 4 uur en een duur van 2 tot 8 uur. Uitdoving van het effect is snel over de eerste 72 uur en na vijf dagen is de activiteit van de trombocytenaggregatie weer bijna op het normale niveau.2 3 Onderzoek Dosisresponsstudies Er zijn twee trials uitgevoerd om de dosisrespons vast te stellen: de DISPERSE- en DISPERSE2-trial. De eerste studie duurde 28 dagen en was een gerandomiseerde, dubbelblinde, dubbeldummy, parallelgroep, multicenterstudie waarbij vooral de farmacokinetiek en -dynamiek werden bekeken van de verschillende doseringen van ticagrelor. Deelnemers met een atherosclerotische aandoening kregen verschillende doseringen gecombineerd met acetylsalicylzuur (ASA): 50, 100, 200 mg tweemaal daags of 400 mg eenmaal daags. De groepen werden vergeleken met de combinatie van clopidogrel 75 mg eenmaal daags en ASA. De oplaaddosis liet voor alle ticagrelordoseringen een hogere plaatjesaggregatieremmende werking zien ten opzichte van clopidogrel. Op de steady state resulteerde de 50 mg ticagrelordosering in eenzelfde trombocytenaggregatieremmende werking als clopidogrel. Hogere doseringen van ticagrelor gaven een sterkere remming dan clopidogrel. Deze hoeveelheden gaven echter een minder sterke toename in trombocytenaggregatieremming, maar wel meer bijwerkingen.
De DISPERSE2-studie was qua design identiek aan DISPERSE, maar vergeleek de veiligheid en verdraagbaarheid van twee doseringen ticagrelor (90 mg tweemaal daags en 180 mg eenmaal daags) met clopidogrel 75 mg, alle gecombineerd met ASA in 990 patiënten met acuut coronair syndroom zonder ST-segmentelevatie (opgetreden in de laatste 48 uur). De verhouding tussen de groepen was 1:1:1 en de studieduur was twaalf weken. De ticagrelor 90 mg-groep gaf over de eerste zes weken een cumulatief hoger risico op bloedingen ten opzichte van de andere twee groepen. Deze verschillen ebden gedurende de studie echter weg. In week 4 waren de verschillen tussen de groepen met betrekking tot de fatale, levensbedreigende en overige ernstige bloedingen gelijk voor alle groepen. Voor beide ticagrelorgroepen was het aantal patiënten dat last kreeg van dyspnoe groter dan voor de clopidogrelgroep (90 mg: 26 (8%), 180 mg: 38 (12%) en clopidogrel: 4 (1,2%). Bovendien was er een kleine stijging in het aantal patiënten dat aritmieën rapporteerde in de ticagrelorgroep ten opzichte van de clopidogrelgroep. Als laatste was er een niet-significante trend in de Kaplan-Meier-curves richting het minder optreden van myocardinfarcten over de gehele studieperiode in de ticagrelorgroep (90 mg tweemaal daag 5,6%, 180 mg eenmaal daags 3,8% en clopidogrel 2,5%).1 4
PLATO-studie 2 4 5
De grootste studie die is uitgevoerd om te kijken naar het effect van ticagrelor bij acute coronaire syndromen, is de PLATelet inhibition and patient Outcomes (PLATO)-studie. Er werden 18.624 patiënten met acuut coronaire syndromen geïncludeerd. Ook patiënten die voor een geplande ingreep op de wachtlijst stonden, zoals coronair angiografie of het plaatsen van een stent (CABG) werden geïncludeerd. PLATO was een gerandomiseerde, dubbelblinde, dubbel-dummy, parallelgroep, fase 3, effectiviteit en veiligheid, multicenterstudie die de verschillen bekeek tussen ticagrelor (180 mg oplaaddosering, daarna 90 mg tweemaal daags) en clopidogrel (300 - 600 mg oplaaddosering en daarna 75 mg eenmaal daags). Het hoofddoel was het bepalen van een meer potente trombocytenaggregatieremmer ter voorkoming van (cardio)vasculaire events. Alle patiënten werden ook behandeld met ASA 75 - 100 mg, tenzij zij daar allergisch voor waren. De duur van de behandeling varieerde van zes tot twaalf maanden afhankelijk van de inclusietijdstip in het studieschema.
Op de primaire eindpunten gezamenlijk (cardiovasculaire dood, myocardinfarct en beroerte) liet ticagrelor een relatief lager risico zien van 16% en een absolute risicoreductie van 1,9% over de twaalf maanden vergeleken met clopidogrel (hazardratio (HR) 0,84; p=0,0003). Ook uitgesplitst op cardiovasculaire dood (4,0% ten opzichte van 5,1%; HR 0,79 (95% BI 0,69; 0,91); p=0,0013, ARR 1,1%) en myocardinfarct (5,8% ten opzichte van 6,9%; HR 0,84 (95% BI 0,75; 0,95); p=0,0045, ARR 1,1%) was ticagrelor superieur ten opzichte van clopidogrel. Een beroerte kwam vaker voor in de ticagrelorgroep (1,5% ten opzichte van 1,3%; HR 1,17 (95% BI 0,91-1,52); p=0,2249). De overall mortaliteit was in de ticagrelorgroep significant lager dan in de clopidogrelgroep (4,5% ten opzichte van 5,9%; HR 0,78 (95% BI 0,69; 0,89); p=0,0003).
Er werden geen significante verschillen gevonden in het voorkomen van ernstige bloedingen tussen ticagrelor en clopidogrel (11,6% ten opzichte van 11,2%; HR 1,04 (95% BI 0,90-1,16); p=0,4336). Werden de ernstige en minder ernstige bloedingen echter gecombineerd dan ontstond er wel een significant verschil tussen beide groepen ten nadele van ticagrelor (16,1% ten opzichte van 14,6%; HR 1,11 (95% BI 1,03-1,20); p=0,0084). Dyspnoe werd gerapporteerd bij 69 patiënten (0,7%) uit de ticagrelorgroep en bij 39 patiënten (0,4%) uit de clopidogrelgroep. Ernstige dyspnoe trad bij ongeveer de helft van patiënten uit beide groepen op (35 ten opzichte van 18 patiënten). Cardiale aritmieën traden in beide groepen evenveel op. Gedurende een continue ECG (cECG)-meting in de PLATO-studie werden wel numeriek meer bradycardieën (41,4% ten opzichte van 39,1%) en dropped beats (33,3% ten opzichte van 30,3%) gezien in de ticagrelorgroep. Renale bijwerking, verhoging van de creatininewaarden, werden meer gezien in de ticagrelorgroep (4,9% ten opzichte van 3,8%). Bijwerkingen De belangrijkste bijwerking lag in de lijn der verwachting en is analoog aan de werking, namelijk bloedingen. Deze bloedingen konden worden uitgesplitst in neusbloedingen, gastro-intestinale bloedingen, huidbloedingen en blauwe plekken. Een andere belangrijke bijwerking is dyspnoe.
Bij minder dan 1% van de patiënten traden de meer algemene bijwerkingen op zoals duizeligheid, hoofdpijn, dyspepsie, buikpijn, diarree en jeuk. Zelden traden op hyperurikemie, verwardheid, paresthesie, oorbloeding, vertigo, obstipatie, hemartrose (gewrichtsbloeding) en stijging van de serumcreatinineconcentratie. Na staken van ticagrelor blijft minimaal gedurende 96 uur het risico op bloedingen bestaan. Bij patiënten die een bypassoperatie moeten ondergaan zijn bloedingen gemeld bij staken van ticagrelor voor de ingreep. Als laatste bijwerking dienen de waargenomen ventriculaire pauzes van langer dan drie seconden te worden genoemd. Interacties Aangezien zowel ticagrelor en haar actieve metaboliet CYP3A4- en P-gp-substraten zijn, zijn er een aantal geneesmiddelinteracties beschreven. Ketoconazol, een sterke CYP3A4-remmer, resulteert in een verhoogde Cmax met factor 2,4 en een verhoogde AUC met een factor 7,4 van ticagrelor en verlaagde Cmax en AUC van AR-C124910XX (89 en 56% respectievelijk). De fabrikant raadt gelijktijdig gebruik van sterke CYP3A4-remmers (zoals claritromycine) met ticagrelor dan ook af. Gelijktijdig gebruik van diltiazem resulteerde in een verhoging van de Cmax met 70% en verhoging van de AUC met een factor 2,7. De farmacokinetiek van ticagrelor werd hierdoor echter amper beïnvloed. Rifampicine, een CYP3A4-inductor, verlaagt de Cmax van ticagrelor met 73% en de AUC met 86%. De verwachting is dat de effectiviteit door deze interactie zal afnemen en de fabrikant heeft de gelijktijdige toepassing van CYP3A4-inductoren met ticagrelor afgeraden. De Cmax en de AUC van CYP3A4-substraat simvastatine stegen met respectievelijk 81 en 56%. De spiegels van de actieve metaboliet simvastatinezuur stegen navenant. Met deze verhoogde spiegels en de daaruit voortkomende verhoogde kans op rhabdomyolyse, raadt de fabrikant een maximumdosering simvastatine van 40 mg aan. Overigens valt een groepseffect niet uit te sluiten daar er ook spiegelstijgingen bij atorvastatine zijn gemeten. Substraten met nauwe therapeutische breedtes / zoals bijvoorbeeld ergotamine / worden eveneens afgeraden. Het P-gp-substraat digoxine gaf na gelijktijdige toediening met ticagrelor een gemiddelde spiegelstijging van 30%. De farmacokinetiek van ticagrelor bleef gelijk. Andere P-gp-substraten geven mogelijk dezelfde spiegelstijging. Aangeraden wordt om de spiegels bij middelen met nauwe therapeutische breedte, zoals digoxine en ciclosporine, te monitoren. Voorzichtigheid is geboden met middelen die de hemostase beïnvloeden / desmopressine bijvoorbeeld / en bij middelen die het risico op bloedingen verhogen (NSAID€™s, SSRI€™s). In verband met de waargenomen ventriculaire pauzes waarschuwt de fabrikant voor het combineren met middelen die bradycardie kunnen veroorzaken. Hieronder vallen bijvoorbeeld de bètablokkers digoxine, diltiazem en verapamil. Als laatste zijn er ook aanwijzingen dat hoge doseringen van acetylsalicylzuur (>150 mg) de werkzaamheid van ticagrelor negatief beïnvloedt.2 3
Contra-indicaties
Overgevoeligheid voor ticagrelor of een component uit het preparaat. Actieve pathologische bloedingen, zoals intercraniale bloedingen en ulcus pepticum worden ook gezien als contra-indicatie. Patiënten die nierdialyse ondergaan en patiënten die lijden aan een matig tot ernstige leverfunctiestoornis wordt het gebruik ontraden. Voorzichtigheid is geboden bij alle aandoeningen met een verhoogd risico op bloedingen, ulcus pepticum, astma/COPD (vanwege het mogelijk verhoogd risico op dyspnoe), jicht of een verhoogd urinezuurgehalte en patiënten met een verhoogd risico op bradycardie.2
Bijzondere voorzorgen
Als patiënten een geplande ingreep zullen ondergaan moet rekening gehouden worden met het feit dat na het staken van ticagrelor er nog een verhoogd risico op bloedingen aanwezig is. Ticagrelor dient zeven dagen voor aanvang van een electieve ingreep te worden gestaakt indien een trombocytenaggregatieremmend effect niet gewenst is. Bovendien adviseert de fabrikant om de nierfunctie een maand na de start van ticagrelor te bepalen en vervolgens ook periodiek. Dit vanwege mogelijke verhoging van de creatinineconcentraties na aanvang en gedurende het gebruik.
Zwangerschap en lactatie
Studies in ratten geven aan dat er geen effecten zijn op de fertiliteit van zowel mannen als vrouwen, zelfs bij een dosering die 16 tot 20 maal hoger ligt dan de gebruiksdosering. Bij toepassing van toxische doseringen (300 mg/kg/dag) werden in ratten wel kleine ontwikkelingsstoornissen in de foetus gezien. Verder gaven andere dierstudies bij hoge doseringen verschillende zeer minimale storingen in de groei of rijping van de vrucht. Volgens de fabrikant wijzen de uitgevoerde studies van ticagrelor in therapeutische dosering niet op reproductietoxiciteit voor de foetus. Echter, gezien de relatief kleine marge die in acht is genomen is, wordt om veiligheidsredenen toch geadviseerd ticagrelor niet te gebruiken gedurende de zwangerschap.2 In farmacodynamische en toxicologische dierstudies is ticagrelor en haar actieve metaboliet gevonden in de moedermelk. Bij mensen zijn er echter geen gegevens bekend over de passage naar de moedermelk. Vanwege het ontbreken hiervan en de aangetoonde overgang naar de dierlijke melk, wordt geadviseerd ticagrelor niet te gebruiken gedurende de borstvoeding.2
Handelspreparaat en prijs
Ticagrelor zal door fabrikant AstraZeneca in Europa worden aangeboden onder de merknaam Possia®. Op moment van schrijven is het nog niet in Nederland verkrijgbaar, maar wel goedgekeurd door de European Medicines Agency, EMA. Het middel zal verschijnen in tabletten die 90 mg ticagrelor bevatten. De prijs is nog niet bekend.
Dosering en gebruiksaanwijzingen
De behandeling met dient gestart te worden met een eenmalige oplaaddosis van 180 mg (twee tabletten van 90 mg) en daarna te worden voortgezet met 90 mg, tweemaal daags. Patiënten die ticagrelor nemen, zullen ook dagelijks acetylsalicylzuur moeten gebruiken, tenzij dit nadrukkelijk is gecontraïndiceerd. De dosering van acetylsalicylzuur dient te liggen tussen de 75 en 150 mg. Het advies is om de behandeling tot twaalf maanden voort te zetten. De ervaring met behandeling langer dan twaalf maanden is beperkt. Bij patiënten met acuut coronair syndroom kan vroegtijdige beëindiging van de trombocytenaggregatie-remmende therapie / inclusief ticagrelor / resulteren in een verhoogd risico op cardiovasculaire dood of een myocardinfarct als gevolg van de onderliggende ziekte. Daarom dient vroegtijdig beëindigen van de behandeling vermeden te worden.
Onderbrekingen in de therapie dienen eveneens vermeden te worden. Patiënten die een dosis ticagrelor zijn vergeten in te nemen, dienen slechts één 90 mg tablet (de volgende dosis) te nemen op het eerstvolgende vaste tijdstip.6
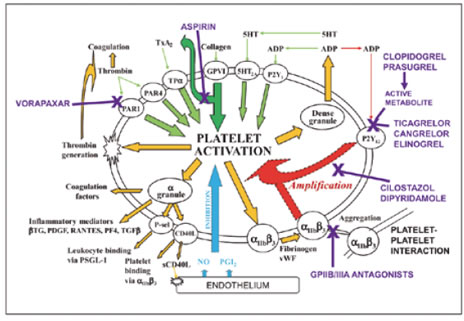
Mechanismen van trombocytenactivatie en
het aangrijpingspunt van verschillende trombocytenaggregatieremmers
(bron: Thrombosis
and Haemostasis Supplement 1/2011, zie ref.
nr. 1)
Conclusie
Vanwege de centrale rol in de trombocytenaggregatie weten steeds meer geneesmiddelenfabrikanten de P2Y12-receptor te vinden. Logischerwijs resulteert dit in een steeds groter wordende groep van geneesmiddelen die als doel hebben deze receptor te inhiberen. Clopidogrel en prasugrel / waarbij prasugrel de meest potente is met een snel intredende werking / zijn de eerste middelen. Beide hebben echter een aangetoonde antitrombotische effectiviteit waarbij hun werkzame metaboliet irreversibel bindt aan de P2Y12-receptor. De PLATO-trial toont aan dat ook de in dit artikel beschreven reversibele remmer van P2Y12-receptor, ticagrelor (Possia®), beschikt over goede eigenschappen om gebruikt te kunnen worden bij patiënten met acuut coronair syndroom.
Toch zijn er nog verschillende zaken die in post-marketing surveillance opgehelderd dienen te worden. De belangrijkste veiligheidsindicator bij trombocytenaggregatieremmers is het risico op bloedingen. Ticagrelor en clopidogrel geven op het vlak van ernstige bloedingen hetzelfde risico. Toch zijn er bepaalde specifieke bloedingen waarbij het risico voor ticagrelor hoger is; zie de samenvatting van de productkenmerken. Wat tevens opviel tijdens de PLATO-studie waren bepaalde bijzondere bijwerkingen, zoals dyspnoe en aritmisch effect op het hart. Ook werd relatief vaak een verhoogd urinezuur gevonden en hoger serumcreatinine. Deze bijwerkingen verdienen extra aandacht om verder op te helderen wat de precieze oorzaak is en of de effecten klinsch relevant blijken te zijn. Een voordeel van ticagrelor is dat de uitscheiding niet via de nieren gaat. Hierdoor heeft een (ernstige) nierfunctiestoornis geen significante invloed op de spiegels en de werking. Wat eveneens voor ticagrelor spreekt zijn de snelle aanvang van de trombocytenaggregatie-remmende werking en de korte halfwaardetijd. Deze twee eigenschappen maken het een aantrekkelijk alternatief voor clopidogrel en prasugrel als snelle remming of vlotte omkering gewenst is.
Kortom, ticagrelor heeft een aantal goede eigenschappen om een aanvulling te zijn op het huidige arsenaal aan antitrombotische preparaten. Maar vanwege het veelal langdurige gebruik van deze middelen dient het veiligheidsprofiel nog beter in kaart te worden gebracht alvorens grootschalige toepassing gestimuleerd kan worden.
Literatuur
1 Storey RF. Pharmacology and clinical trials of reversibly-binding P2Y12-inhibitors. Thromb Haemost Supplement 2011 Apr 11; (Suppl.1). [Epub ahead of print]
2 Assessment Report for Possia. International non-proprietary name: ticagrelor. EMEA/H/C/2303.
3 Informatorium Medicamentorium. Geraadpleegd 10-05-2011.
4 Lombo B, Díez JG. Ticagrelor: the evidence for its clinical potential as an oral antiplatelet treament for the reduction of major adverse cardiac events in patients with acute coronary syndromes. Core Evidence 2011;6:31-42.
5 James S, Akerblom A, Cannon CP et al. Comparison of ticagrelor, the first reversible oral P2Y12-receptor antagonist,
with clopidogrel in patients with acute coronary syndromes: rationale, design, and baseline characteristics of the PLATelet inhibition and patient Outcomes (PLATO) trial. Am Heart J 2009;157:599-605.
6 Summary of Product Characteristics Possia. Geraadpleegd 30-05-2011.